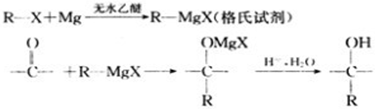
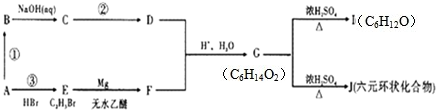
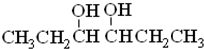题目内容
15.1克SO2含有n个O原子,则阿佛加德罗常数可表示为( )| A. | 64n | B. | $\frac{1}{64}$n | C. | 32n | D. | $\frac{3}{64}$n |
分析 根据n=$\frac{m}{M}$计算出1g二氧化硫的物质的量,然后计算出含有O原子的物质的量,最后根据阿伏伽德罗常数的计算表达式NA=$\frac{N}{n}$计算出阿伏伽德罗常数.
解答 解:1g二氧化硫的物质的量为:n=$\frac{1g}{64g/mol}$=$\frac{1}{64}$mol,含有O原子的物质的量为:$\frac{1}{64}$mol×2=$\frac{1}{32}$mol,
则阿伏伽德罗常数为:NA=$\frac{N}{n}$=$\frac{n}{\frac{1}{32}}$=32n,
故选C.
点评 本题考查了阿伏伽德罗常数的计算,题目难度中等,明确阿伏伽德罗常数的概念及表达式即可解答,注意熟练掌握物质的量与摩尔质量、阿伏伽德罗常数等物理量之间的转化关系.

练习册系列答案
相关题目
4.甲醇、空气和强碱溶液做电解质的手机燃料电池中所发生的反应为:2CH3OH+3O2+4OH-$?_{充电}^{放电}$2CO32-+6H2O,下列有关说法正确的是( )
| A. | 放电时,CH3OH参与反应的电极为正极 | |
| B. | 放电时,负极反应为:CH3OH-6e-+8OH-═CO32-+6H2O | |
| C. | 充电时,电解质溶液的pH逐渐增大 | |
| D. | 放电时,每通入标况下11.2L O2完全反应转移电子数为1mol |
6.下列常见有机物中,无同分异构体的是( )
| A. | 乙醇 | B. | 二氯乙烷 | C. | 甲醛 | D. | 乙酸 |
3.物质的量浓度相等的下列溶液,pH值由大到小的顺序是( )
| A. | NH4Cl NaCl NaHCO3 Na2CO3 | |
| B. | NaHCO3 Na2CO3 NH4Cl NaCl | |
| C. | Na2CO3 NaHCO3 NaCl NH4Cl | |
| D. | Na2CO3 NH4Cl NaHCO3 NaCl |
10.下列各组离子,在强碱性溶液中可以大量共存的是( )
| A. | Cu2+、Cl-、NO3-、Na+ | B. | Na+、K+、NH4+、Ba2+ | ||
| C. | Na+、S2-、Cl-、CO32- | D. | K+、NO3-、SO42-、HCO3- |
5.Na2O2、CaC2、CaH2、FeS2均为离子化合物,前三种物质极易与水反应下列有关叙述中正确的是( )
| A. | 1molNa2O2与水反应转移2mol电子 | |
| B. | CaH2在水中以Ca2+和H-离子形式存在 | |
| C. | 四种化合物晶体类型和化学键类型均相同 | |
| D. | FeS2阴离子电子式为 |
 苹果酸是一种常见的有机酸,其结构简式如图
苹果酸是一种常见的有机酸,其结构简式如图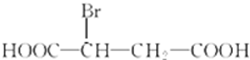 +H2O$\stackrel{一定条件}{→}$
+H2O$\stackrel{一定条件}{→}$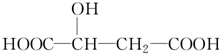 +HBr.
+HBr.