题目内容
高铁酸钾(K2FeO4)具有很强的氧化性,在生产、生活中有广泛应用.
(1)K2FeO4常用做高效水处理剂,其两种作用分别是______.[已知:FeO42-+3e-+4H2O?Fe(OH)3+5OH-]
(2)制备K2FeO4可以采用湿式氧化法,流程如图:
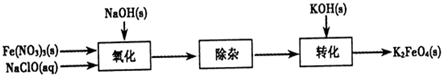
①完成氧化工序的离子方程式:□ClO-+□Fe3+□______═□FeO42-+□Cl-+□______.
②除杂工序目的是除去Na2FeO4溶液中的杂质,除去的杂质主要有______(写化学式).
③转化工序控制在某温度下进行,则该温度下溶解度:Na2FeO4______K2FeO4(填“>”、“<”或“=”).
(3)实验室模拟工业电解法制取K2FeO4,装置如图.
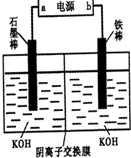
①此装置中电源的负极是______(填“a”或“b”).
②阳极的电极反应式为______.
(4)已知K2FeO4稀溶液中存在如下平衡:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2实验测得K2FeO4溶液浓度与温度和pH的关系分别如图:
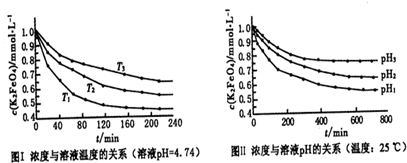
①由图I可得出的结论:该反应的△H______ 0(填“>”、“<”或“=”).
②图Ⅱ中pH1______pH3(填“>”、“<”或“=”).
(1)K2FeO4常用做高效水处理剂,其两种作用分别是______.[已知:FeO42-+3e-+4H2O?Fe(OH)3+5OH-]
(2)制备K2FeO4可以采用湿式氧化法,流程如图:

①完成氧化工序的离子方程式:□ClO-+□Fe3+□______═□FeO42-+□Cl-+□______.
②除杂工序目的是除去Na2FeO4溶液中的杂质,除去的杂质主要有______(写化学式).
③转化工序控制在某温度下进行,则该温度下溶解度:Na2FeO4______K2FeO4(填“>”、“<”或“=”).
(3)实验室模拟工业电解法制取K2FeO4,装置如图.

①此装置中电源的负极是______(填“a”或“b”).
②阳极的电极反应式为______.
(4)已知K2FeO4稀溶液中存在如下平衡:4FeO42-+10H2O?4Fe(OH)3+8OH-+3O2实验测得K2FeO4溶液浓度与温度和pH的关系分别如图:

①由图I可得出的结论:该反应的△H______ 0(填“>”、“<”或“=”).
②图Ⅱ中pH1______pH3(填“>”、“<”或“=”).
(1)高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂,起到杀菌消毒作用,形成胶体具有吸附悬浮杂质的作用;
故答案为:杀菌消毒、吸附悬浮物;
(2)①反应中Fe3+→FeO42-,铁元素化合价由+3价升高为+6价,化合价总升高3价,ClO-→Cl-,氯元素化合价由+1降低为-1价,化合价总共降低2价,化合价升降最小公倍数为6,故Fe3+系数为2,ClO-系数为3,由铁元素守恒可知FeO42-系数为2,由氯元素守恒可知Cl-系数为3,根据钠元素守恒可知OH-系数为10,由氢元素守恒可知H2O系数为5,配平离子方程式:3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5 H2O,故答案为:3、2、10OH-、2、3、5H2O;
②根据反应物和生成物确定杂质为NaNO3、NaCl,故答案为:NaNO3、NaCl;
③沉淀向溶解度更小的方向转化,K2FeO4的溶解度更小,故答案为:>;
(3)①活泼金属做阳极,金属失电子,则b为正极,a为负极,故答案为:a;
②阳极上铁失电子生成FeO42-,1mol铁失去6mol电子,电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O,故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
(4)①由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,正向反应是吸热反应,故答案为:>;
②pH越小,氢离子浓度越大,平衡向正反应方向移动,高铁酸钾溶液平衡时FeO42-浓度越小,由图知pH1<pH3,故答案为:<.
故答案为:杀菌消毒、吸附悬浮物;
(2)①反应中Fe3+→FeO42-,铁元素化合价由+3价升高为+6价,化合价总升高3价,ClO-→Cl-,氯元素化合价由+1降低为-1价,化合价总共降低2价,化合价升降最小公倍数为6,故Fe3+系数为2,ClO-系数为3,由铁元素守恒可知FeO42-系数为2,由氯元素守恒可知Cl-系数为3,根据钠元素守恒可知OH-系数为10,由氢元素守恒可知H2O系数为5,配平离子方程式:3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5 H2O,故答案为:3、2、10OH-、2、3、5H2O;
②根据反应物和生成物确定杂质为NaNO3、NaCl,故答案为:NaNO3、NaCl;
③沉淀向溶解度更小的方向转化,K2FeO4的溶解度更小,故答案为:>;
(3)①活泼金属做阳极,金属失电子,则b为正极,a为负极,故答案为:a;
②阳极上铁失电子生成FeO42-,1mol铁失去6mol电子,电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O,故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
(4)①由图1数据可知,温度越高,相同时间内FeO42-浓度变化越快,高铁酸钾溶液平衡时FeO42-浓度越小,温度越高FeO42-浓度越小,正向反应是吸热反应,故答案为:>;
②pH越小,氢离子浓度越大,平衡向正反应方向移动,高铁酸钾溶液平衡时FeO42-浓度越小,由图知pH1<pH3,故答案为:<.

练习册系列答案
相关题目

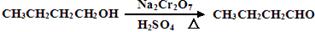 。反应物和产物的相关数据列表如下:
。反应物和产物的相关数据列表如下:
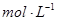 NaOH溶液中,判断锌层完全反应的标志是:__________,最后,取出铁片用水冲洗、烘干后称量,得质量为m2,设锌镀层单侧厚度为h,锌的密度为
NaOH溶液中,判断锌层完全反应的标志是:__________,最后,取出铁片用水冲洗、烘干后称量,得质量为m2,设锌镀层单侧厚度为h,锌的密度为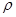 ,则h=__________
,则h=__________ 含量的步骤是:称1g绿矾,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol/L KMnO4标准溶液滴定到溶液刚变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
含量的步骤是:称1g绿矾,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol/L KMnO4标准溶液滴定到溶液刚变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有: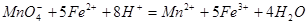
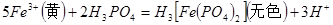
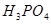 的作用是__________。
的作用是__________。