题目内容
(14分)实验和探究对化学学科的发展起着非常重要的作用
(1)写出下列实验过程中所体现的总的离子反应方程式:
①用PH试纸测得醋酸钠溶液呈碱性:__________
②用石墨做电极,电解硝酸银溶液后,溶液呈酸性:__________
③根据浑浊出现的快慢,探究硫代硫酸钠与酸反应速率的影响因素:__________
(2)已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放入6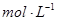 NaOH溶液中,判断锌层完全反应的标志是:__________,最后,取出铁片用水冲洗、烘干后称量,得质量为m2,设锌镀层单侧厚度为h,锌的密度为
NaOH溶液中,判断锌层完全反应的标志是:__________,最后,取出铁片用水冲洗、烘干后称量,得质量为m2,设锌镀层单侧厚度为h,锌的密度为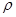 ,则h=__________
,则h=__________
(3)实验室测定绿矾中FeSO4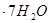 含量的步骤是:称1g绿矾,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol/L KMnO4标准溶液滴定到溶液刚变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
含量的步骤是:称1g绿矾,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol/L KMnO4标准溶液滴定到溶液刚变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
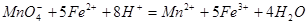
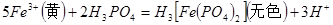
①绿矾的含量为__________%。
②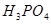 的作用是__________。
的作用是__________。
(1)写出下列实验过程中所体现的总的离子反应方程式:
①用PH试纸测得醋酸钠溶液呈碱性:__________
②用石墨做电极,电解硝酸银溶液后,溶液呈酸性:__________
③根据浑浊出现的快慢,探究硫代硫酸钠与酸反应速率的影响因素:__________
(2)已知锌能溶解在NaOH溶液中,产生H2。某同学据此设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S、质量为m1的镀锌铁皮与石墨用导线相连,放入6
 NaOH溶液中,判断锌层完全反应的标志是:__________,最后,取出铁片用水冲洗、烘干后称量,得质量为m2,设锌镀层单侧厚度为h,锌的密度为
NaOH溶液中,判断锌层完全反应的标志是:__________,最后,取出铁片用水冲洗、烘干后称量,得质量为m2,设锌镀层单侧厚度为h,锌的密度为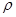 ,则h=__________
,则h=__________(3)实验室测定绿矾中FeSO4
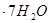 含量的步骤是:称1g绿矾,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol/L KMnO4标准溶液滴定到溶液刚变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有:
含量的步骤是:称1g绿矾,用30mL蒸馏水溶解并加入H2SO4溶液和H3PO4溶液,再用0.02mol/L KMnO4标准溶液滴定到溶液刚变成粉红色,停止滴定,消耗标准溶液VmL。反应中涉及的重要化学方程式有: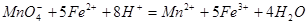
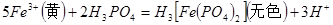
①绿矾的含量为__________%。
②
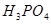 的作用是__________。
的作用是__________。(1)①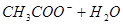

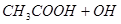
②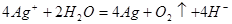
③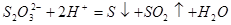
(2)产生氢气速率突然变慢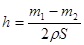
(3)2.78V% 消除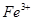 的颜色干扰
的颜色干扰
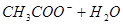

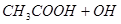
②
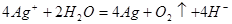
③
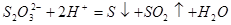
(2)产生氢气速率突然变慢
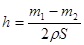
(3)2.78V% 消除
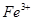 的颜色干扰
的颜色干扰(1)①醋酸钠是强碱弱酸盐,水解显碱性,方程式为CH3COO-+H2O CH3COOH+OH-。
CH3COOH+OH-。
②用石墨做电极,电解硝酸银溶液后,阳极OH-放电,生成氧气,从而破坏水的电离平衡,因此溶液中氢离子大于OH-浓度,显酸性,方程式为4Ag++2H2O 4Ag+4H++O2↑。
4Ag+4H++O2↑。
③在酸性条件下,硫代硫酸钠发生氧化还原反应生成单质S和SO2,方程式为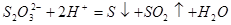 。
。
(2)当锌完全被消耗之后,溶液中就不再产生氢气,即产生氢气的速率突然变慢时,就说明反应已知停止。参加反应的锌是m1-m2,所以有2hS=m1-m2,解得h=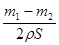 。
。
(3)①消耗高锰酸钾是2V×10-5mol,所以绿矾的物质的量是2V×10-5mol×5=V×10-4mol,所以含量是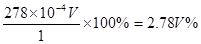 .
.
②由于铁离子在溶液中显棕黄色,能干扰终点的颜色判断,所以磷酸的作用是消除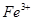 的颜色干扰。
的颜色干扰。
 CH3COOH+OH-。
CH3COOH+OH-。②用石墨做电极,电解硝酸银溶液后,阳极OH-放电,生成氧气,从而破坏水的电离平衡,因此溶液中氢离子大于OH-浓度,显酸性,方程式为4Ag++2H2O
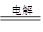 4Ag+4H++O2↑。
4Ag+4H++O2↑。③在酸性条件下,硫代硫酸钠发生氧化还原反应生成单质S和SO2,方程式为
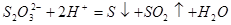 。
。(2)当锌完全被消耗之后,溶液中就不再产生氢气,即产生氢气的速率突然变慢时,就说明反应已知停止。参加反应的锌是m1-m2,所以有2hS=m1-m2,解得h=
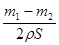 。
。(3)①消耗高锰酸钾是2V×10-5mol,所以绿矾的物质的量是2V×10-5mol×5=V×10-4mol,所以含量是
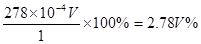 .
.②由于铁离子在溶液中显棕黄色,能干扰终点的颜色判断,所以磷酸的作用是消除
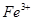 的颜色干扰。
的颜色干扰。
练习册系列答案
相关题目
 晶体时,将湿润的红色石蕊试纸靠近试管口,检验
晶体时,将湿润的红色石蕊试纸靠近试管口,检验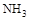 的生成
的生成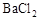 溶液,有白色沉淀生成,说明原溶液中存在
溶液,有白色沉淀生成,说明原溶液中存在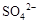
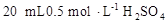 溶液于烧杯中,加水80mL,,配制成0.1
溶液于烧杯中,加水80mL,,配制成0.1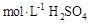 溶液
溶液