题目内容
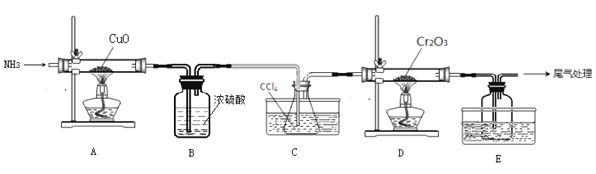
【题目】某课外活动小组将如图所示装置按一定顺序连接,在实验室里制取一定量的![]() 所通气体过量并充分反应
所通气体过量并充分反应![]() 。请回答下列问题:
。请回答下列问题:
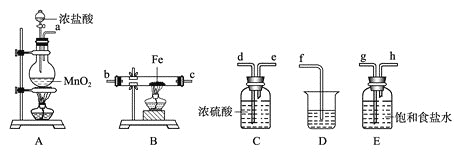
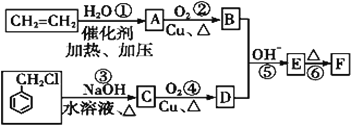
![]() 中发生反应的化学方程式为_____________________。
中发生反应的化学方程式为_____________________。
![]() 各装置的正确连接顺序为
各装置的正确连接顺序为![]() 填写装置代号
填写装置代号![]() ____
____![]() ____
____![]() ____
____![]() 。
。
![]() 写出装置D中反应的离子方程式_____________________。
写出装置D中反应的离子方程式_____________________。
![]() 反应结束后,可以检验B中生成物中含有
反应结束后,可以检验B中生成物中含有![]() 的试剂是_______
的试剂是_______![]() 填写试剂名称
填写试剂名称![]() 。
。
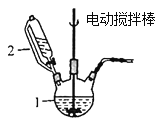
![]() 该小组欲用如图所示装置收集尾气,并测量多余气体的体积。
该小组欲用如图所示装置收集尾气,并测量多余气体的体积。
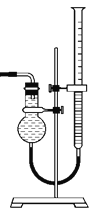
![]() 若图中所示量气装置由干燥管、乳胶管和
若图中所示量气装置由干燥管、乳胶管和![]() 滴定管改造后组装而成,此处所用滴定管是_____________
滴定管改造后组装而成,此处所用滴定管是_____________![]() 填“酸式”或“碱式”
填“酸式”或“碱式”![]() 滴定管。
滴定管。
![]() 为提高测量的准确性,上图装置中的液体可用___________。
为提高测量的准确性,上图装置中的液体可用___________。
![]() 如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致所测气体的体积_______
如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致所测气体的体积_______![]() 填“偏大”、“偏小”或“无影响”
填“偏大”、“偏小”或“无影响”![]() 。
。
【答案】![]() 浓
浓![]()
![]()
![]() E C B
E C B ![]() 硫氰化钾 碱式 饱和NaCl溶液 偏大
硫氰化钾 碱式 饱和NaCl溶液 偏大
【解析】
![]() 中制取氯气,二氧化锰与浓盐酸反应生成氯化锰、氯气、水;
中制取氯气,二氧化锰与浓盐酸反应生成氯化锰、氯气、水;
![]() 制备氯气中含有氯化氢和水蒸气,除去氯化氢气体用饱和食盐水,除去水蒸气用浓硫酸,应先除氯化氢,后干燥,最后吸收尾气中未反应的氯气,防止污染空气;
制备氯气中含有氯化氢和水蒸气,除去氯化氢气体用饱和食盐水,除去水蒸气用浓硫酸,应先除氯化氢,后干燥,最后吸收尾气中未反应的氯气,防止污染空气;
![]() 中反应是利用氢氧化钠溶液吸收多余的氯气;
中反应是利用氢氧化钠溶液吸收多余的氯气;
![]() 用KSCN溶液检验
用KSCN溶液检验![]() ;
;
![]() 酸式滴定管下端有活塞;
酸式滴定管下端有活塞;
![]() 能溶于水而难溶于饱和食盐水,故应用饱和食盐水,从而提高测量的准确性;
能溶于水而难溶于饱和食盐水,故应用饱和食盐水,从而提高测量的准确性;
![]() 俯视时,读取的液面的数值比实际偏小,滴定管内测量前后溶液体积变化偏大。
俯视时,读取的液面的数值比实际偏小,滴定管内测量前后溶液体积变化偏大。
![]() 中制取氯气,二氧化锰与浓盐酸反应生成氯化锰、氯气、水,反应方程式为
中制取氯气,二氧化锰与浓盐酸反应生成氯化锰、氯气、水,反应方程式为![]() 浓
浓![]()
![]()
![]() ;
;
![]() 制备氯气中含有氯化氢和水蒸气,除去氯化氢气体用饱和食盐水,除去水蒸气用浓硫酸,应先除氯化氢,后干燥,最后吸收尾气中未反应的氯气,防止污染空气,所以装置顺序为
制备氯气中含有氯化氢和水蒸气,除去氯化氢气体用饱和食盐水,除去水蒸气用浓硫酸,应先除氯化氢,后干燥,最后吸收尾气中未反应的氯气,防止污染空气,所以装置顺序为![]() ,
,
故答案为:E;C;B;
![]() 中反应是利用氢氧化钠溶液吸收多余的氯气,反应的离子方程式为:
中反应是利用氢氧化钠溶液吸收多余的氯气,反应的离子方程式为:![]() ;
;
![]() 用KSCN溶液检验
用KSCN溶液检验![]() ,滴加KSCN溶液,溶液变成血红色,说明含有
,滴加KSCN溶液,溶液变成血红色,说明含有![]() ,故答案为:硫氰酸钾;
,故答案为:硫氰酸钾;
![]() 酸式滴定管下端有活塞,无法装配测量气体体积的装置,应用去掉胶管和玻璃球的碱式滴定管,故答案为:碱式;
酸式滴定管下端有活塞,无法装配测量气体体积的装置,应用去掉胶管和玻璃球的碱式滴定管,故答案为:碱式;
![]() 能溶于水而难溶于饱和食盐水,故应用饱和食盐水,从而提高测量的准确性,故答案为:饱和食盐水;
能溶于水而难溶于饱和食盐水,故应用饱和食盐水,从而提高测量的准确性,故答案为:饱和食盐水;
![]() 俯视时,读取的液面的数值比实际偏小,滴定管内测量前后溶液体积变化偏大,导致所测气体的体积偏大,故答案为:偏大。
俯视时,读取的液面的数值比实际偏小,滴定管内测量前后溶液体积变化偏大,导致所测气体的体积偏大,故答案为:偏大。