题目内容
16.某学生为分离乙酸乙酯、乙酸、乙醇的混和物设计如下分离操作步骤流程图:
试回答下列问题:
(1)a试剂的化学式Na2CO3,b试剂的名称浓硫酸;
(2)操作Ⅰ的名称是分液,操作Ⅱ的名称是蒸馏;
(3)写出操作Ⅲ过程中发生反应化学方程式2CH3COONa+H2SO4(浓)$\stackrel{△}{→}$2CH3COOH↑+Na2SO4.
分析 乙醇易溶于水,乙酸能和碳酸钠反应生成可溶性的乙酸钠和二氧化碳、水,乙酸乙酯不溶于饱和碳酸钠,所以向混合溶液中加入饱和碳酸钠溶液a,然后采用分液方法分离,得到液体A为乙酸乙酯,水层中含有乙醇、乙酸钠,采用蒸馏方法得到沸点为78.5℃的乙醇C,得到水层D,D中含有乙酸钠,向D中加入浓硫酸生成乙酸,且浓硫酸具有高沸点特点,然后采用蒸馏方法得到馏分E为乙酸,据此分析解答.
解答 解:乙醇易溶于水,乙酸能和碳酸钠反应生成可溶性的乙酸钠和二氧化碳、水,乙酸乙酯不溶于饱和碳酸钠,所以向混合溶液中加入饱和碳酸钠溶液a,然后采用分液方法分离,得到液体A为乙酸乙酯,水层中含有乙醇、乙酸钠,采用蒸馏方法得到沸点为78.5℃的乙醇C,得到水层D,D中含有乙酸钠,向D中加入浓硫酸生成乙酸,且浓硫酸具有高沸点特点,然后采用蒸馏方法得到馏分E为乙酸,
(1)通过以上分析知,a为Na2CO3,b为浓硫酸,
故答案为:Na2CO3;浓硫酸;
(2)通过以上分析知,I为分液、III为蒸馏,故答案为:分液;蒸馏;
(3)乙酸钠和浓硫酸反应生成乙酸和硫酸钠,反应方程式为2CH3COONa+H2SO4(浓)$\stackrel{△}{→}$2CH3COOH↑+Na2SO4,
故答案为:2CH3COONa+H2SO4(浓)$\stackrel{△}{→}$2CH3COOH↑+Na2SO4.
点评 本题考查物质分离和提纯,为高频考点,明确物质性质及分离方法关系是解本题关键,利用物质性质的差异性选取合适的方法分离,常见物质分离方法有:分液、蒸馏、过滤、渗析、盐析等.

练习册系列答案
相关题目
3.下列名词不是物理量专有名词的是( )
| A. | 时间 | B. | 物质的量 | C. | 质量 | D. | 摩尔 |
1.某无色透明的溶液中含有Cu2+、Mg2+、A13+、Ba2+、H+、Ag+、SO42-、HCO3-、OH-、NO3-中的三种离子,若向其中加入石蕊试液,溶液显蓝色;则原溶液中可能存在的离子是( )
| A. | Ba2+、OH-、NO3- | B. | Cu2+、HCO3-、NO3- | C. | Mg2+、A13+、SO42- | D. | Mg2+、SO42-、OH- |
8.下列有关海水提溴的叙述中,不正确的是( )
| A. | 利用空气吹出法提溴的过程为氯化→吹出→吸收 | |
| B. | 海水中的溴是以Br2形式存在,利用空气吹出法可获得Br2 | |
| C. | 吸收过程中,先用SO2将Br2还原为HBr,再用Cl2氧化HBr得到Br2 | |
| D. | 氯化过程发生的反应为2Br-+Cl2═Br2+2Cl- |
5.美国现任总统奥巴马就环境问题公开表示,到2020年,美国将会把温室气体排放量削减到1990年水平的80%,此外美国将把新能源比重提高到30%.奥巴马还计划每年拿出150亿美元大举投资太阳能、风能和生物质能等,并且举全国之力构建美国的低碳经济领袖地位.下列说法不正确的是( )
| A. | CO2、甲烷都属于温室气体 | |
| B. | 用甘蔗生产的燃料乙醇属可再生能源,利用乙醇燃料不会产生温室气体 | |
| C. | 太阳能、风能和生物质能属于新能源 | |
| D. | 太阳能电池可将太阳能直接转化为电能 |
6.下列芳香烃的一氯代物的同分异构体的数目最多是( )
| A. | 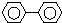 连二苯 | B. | 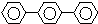 连三苯 | C. | 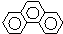 菲 | D. | 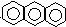 蒽 |