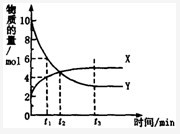
题目内容
工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
A.10 min内,T1时CH4的化学反应速率比T2时小 B.温度:T1<T2
C.ΔH:a < 0 D.平衡常数:K(T1)<K(T2)
D
解析试题分析:A、根据公式v=△n/V△t计算,10 min内,T1时υ(CH4)=0.015mol?L-1?min-1,T2时时υ(CH4)=0.02mol?L-1?min-1,T1时υ(CH4)比T2时小,正确;B、升高温度,反应速率加快,T2>T1,正确;C、温度升高,甲烷剩余量增多,说明平衡向逆反应方向移动,正反应放热,所以a<0,正确;D、T1时反应进行的更为彻底,因此平衡常数更大,K(T1)>K(T2),错误。
考点:考查化学反应速率和化学平衡。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案一定温度下,向体积为2L的密闭容器中充入1mol PCl5(g),发生反应:
PCl5(g)  PCl3(g) +Cl2(g) △H=+Qkj.mol-1维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是
PCl3(g) +Cl2(g) △H=+Qkj.mol-1维持容器温度不变,测得容器内压强随反应时间的变化如图所示。下列说法正确的是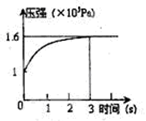
| A.3s内的平均速率为:v(PCl3)="0.1" mol·L-1.s-1 |
| B.达到平衡时放出0.6Q kJ热量 |
| C.其他条件不变,升高温度,平衡常数减小 |
| D.其他条件不变,再向容器中充入1mol PCl5(g),则达新平衡时,c(PCl5)>0.4mol·L-1 |
反应3Fe(s)+4H2O(g)  Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。下列叙述能表明反应达到平衡状态的是
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。下列叙述能表明反应达到平衡状态的是
| A.容器内压强不再改变 | B.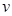 (H2O)= (H2O)=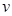 (H2) (H2) |
| C.气体的密度不再改变 | D.反应不再进行 |
在C(s)+CO2(g)===2CO(g)的反应中,现采取下列措施:
①缩小体积,增大压强 ②增加碳的量 ③通入CO2 ④恒容下充入N2
⑤恒压下充入N2能够使反应速率增大的措施是( )
| A.①④ | B.②③⑤ | C.①③ | D.①②④ |
一定温度下,在体积一定的密闭容器中进行的可逆反应:C(s) + CO2(g)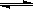 2CO(g),不能判断反应已经达到化学平衡状态的是
2CO(g),不能判断反应已经达到化学平衡状态的是
| A.v(CO2)= v(CO) | B.容器中总压强不变 |
| C.容器中混合气体的密度不变 | D.容器中CO的体积分数不变 |
下列措施对增大反应速率明显有效的是( )
| A.Na与水反应时增大水的用量 |
| B.Fe与稀硫酸反应制取氢气时,改用浓硫酸 |
| C.在H2SO4与Na2CO3两溶液反应时,增大压强 |
D.反应N2+3H2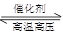 2NH3恒容增加氮气 2NH3恒容增加氮气 |
运用相关化学知识进行判断,下列结论错误的是
| A.某吸热反应能自发进行,因此该反应是熵增反应 |
| B.NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
| C.可燃冰主要甲烷与水在低温高压下形成的水合物晶体,因此可存在于海底 |
| D.增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |