题目内容
一定温度下,在密闭容器内进行某一反应,X气体、Y气体的物质的量随反应时间变化的曲线如图所示。则下列叙述中正确的是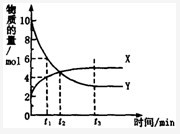
A .反应的化学方程式为2Y(g)=X(g)
B. t1时,Y的浓度是X浓度的1.5倍
C .t2时,可逆反应达到化学平衡状态
D.t3时,逆反应速率大于正反应速率
B
解析试题分析:A、由题给图像知,反应的化学方程式为2Y(g) X(g),错误;B、由题给图像知, t1时,Y的浓度是X浓度的1.5倍,正确;C、由题给图像知,t2时,X、Y的物质的量相等,但不是化学平衡状态,错误;D、由题给图像知,t3时反应达平衡状态,逆反应速率等于正反应速率,错误。
X(g),错误;B、由题给图像知, t1时,Y的浓度是X浓度的1.5倍,正确;C、由题给图像知,t2时,X、Y的物质的量相等,但不是化学平衡状态,错误;D、由题给图像知,t3时反应达平衡状态,逆反应速率等于正反应速率,错误。
考点:考查化学平衡图像。

练习册系列答案
相关题目
决定化学反应速率的主要因素是
| A.反应物的浓度 | B.反应温度 | C.使用催化剂 | D.反应物的性质 |
下列措施是为了降低化学反应速率的是
| A.食品放在冰箱中贮藏 |
| B.双氧水制氧气时加入少量二氧化锰 |
| C.试管中进行镁和水反应时,稍微加热 |
| D.铁粉代替铁钉与稀硫酸反应制取氢气 |
工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
| 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
A.10 min内,T1时CH4的化学反应速率比T2时小 B.温度:T1<T2
C.ΔH:a < 0 D.平衡常数:K(T1)<K(T2)
N2+3H2一定条件2NH3,是工业上制造氮肥的重要反应。下列关于该反应的说法正确的是
| A.增加N2的浓度能加快反应速率 |
| B.降低体系温度能加快反应速率 |
| C.使用催化剂不影响反应速率 |
| D.若反应在密闭容器中进行,N2和H2能100%转化为NH3 |
在盛有足量M的体积可变的密容器中加入N,发生反应:M(s)+2N(g) 4P (g)+Q(g)
4P (g)+Q(g)
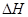 <0。在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的变化关系如图所示。下列说法正确的是:
<0。在一定温度、压强下达到平衡,平衡时P的物质的量与起始时加入N的物质的量的变化关系如图所示。下列说法正确的是: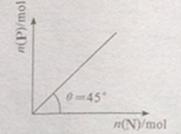
| A.平衡时N的转化率为50% |
B.当温度升高后,则图中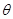 >45 >45 |
| C.若再加入N,则正、逆反应速率均逐渐增大 |
| D.若再加入N,则反应体系中气体密度减小 |
下列事实不能用勒夏特列原理解释的是 ( )
| A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率 |
| B.合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率; |
| C.过氧化氢分解加二氧化锰作催化剂,使单位时间内产生的氧气的量多。 |
| D.久制的氯水PH值变小。 |
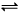 2C(g) ,下列关于该反应达到平衡状态的标志的说法中不正确的是
2C(g) ,下列关于该反应达到平衡状态的标志的说法中不正确的是  2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是
2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是