��Ŀ����
����Ŀ����֪ij�¶��£�Ksp��AgCl��=1.56��10��10 �� Ksp��Ag2CrO4��=1��10��12 �� ���й��ڸ��¶��µ�������ȷ���ǣ� ��
A.���Ȼ���������Һ�м����Ȼ�����Һ��Ksp��AgCl����С
B.����AgCl��Һ�뱥��Ag2CrO4��Һ��ȣ�ǰ�ߵ�c��Ag+����
C.����0.0008molL��1��K2CrO4��Һ�м�������0.002 molL��1��AgNO3��Һ����CrO42������ȫ����
D.����0.001molL��1AgNO3��Һ����Ũ�Ⱦ�Ϊ0.001 molL��1��KCl��K2CrO4�����Һ�У����Ȳ���AgCl����
���𰸡�D
���������⣺A���¶Ȳ�����Ksp���䣬��A���� B������AgCl��Һ��c2��Ag+��=Ksp��AgCl��=1.56��10��10 �� ����Ag2CrO4��Һ�� ![]() =Ksp��Ag2CrO4��=1��10��12 �� ��Ȼ���ߵ�c��Ag+����B����
=Ksp��Ag2CrO4��=1��10��12 �� ��Ȼ���ߵ�c��Ag+����B����
C��CrO42������ȫ������c��CrO42��������10��5molL��1 �� ��ʱc��Ag+���� ![]() =3.2��10��4molL��1 �� ��Ӧ��0.0008molL��1��K2CrO4��Һ�м������[3.2��10��4+2��0.0004��10��5��]��2=2.2��10��3molL��1 �� ��C����
=3.2��10��4molL��1 �� ��Ӧ��0.0008molL��1��K2CrO4��Һ�м������[3.2��10��4+2��0.0004��10��5��]��2=2.2��10��3molL��1 �� ��C����
D������AgCl��Һ��c��Ag+���ȱ���Ag2CrO4��Һ��c��Ag+��С������ͬŨ�ȵ�KCl��K2CrO4�����Һ�е���AgNO3��Һ��������AgCl��������D��ȷ��
��ѡD��
A��AgCl��Kspֻ���¶��йأ������ӵ�Ũ���йأ�
B������AgCl��Һ��c2��Ag+��=Ksp��AgCl��=1.56��10��10 �� ����Ag2CrO4��Һ�� ![]() =Ksp��Ag2CrO4��=1��10��12 �� �ɴ˷������
=Ksp��Ag2CrO4��=1��10��12 �� �ɴ˷������
C���������߷�Ӧ��Ȼ�����ʣ�������ӣ�����ܶȻ���CrO42�����ӵ�Ũ����1.0��10��5mol/L�Ƚϣ�
D������Ksp��AgCl����Ksp��Ag2CrO4������Cl����CrO42����ʼ����ʱc��Ag+�����Ƕ��٣�

 �¸��̵�ѧϵ�д�
�¸��̵�ѧϵ�д� ����ͬѧһ����ʦȫ�źþ�ϵ�д�
����ͬѧһ����ʦȫ�źþ�ϵ�д�����Ŀ���������������һ���������ܼ�������������ܼ���ʵ�����Ʊ�������������ķ�Ӧԭ����ʵ��װ�ü�����������£�3CH3COOH+ ![]()
![]()
![]() +3H2O
+3H2O
���� | ��� | �ܶ�/gcm��3 | �е�/�� | ˮ�� |
���� | 92 | 1.2636 | 290 | �� |
���� | 60 | 1.0492 | 118 | �� |
����������� | 218 | 1.1596 | 258 | ���� |

ʵ�鲽�裺
����1����500mL��Ӧ���м���200g�����ᣬ92g���ͺ�100mL���������������������Ӳ��¶ȼƿڼ���3mLŨ����������Ȳ�����1h��ֹͣ���ȣ�
����2����5%̼������Һϴ�ӣ�����ˮϴ�ӣ���������ˮ�Ȼ��ƣ�
����3���Ƚ��г�ѹ�����ռ�75��85����֣�
����4������ѹ����ٽ��м�ѹ�����ռ�128��131��/933Pa��֣����յò�Ʒ176g��
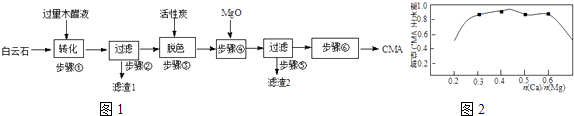
��1������1�ȿ����������Ũ�����Ŀ�����������������Ŀ����
��2����5%̼������Һϴ�ӵ���ҪĿ����������ˮ�Ȼ��Ƶ�Ŀ����
��3������ü�ѹ��������ó�ѹ������ԭ����
��4������ʵ�����Ϊ ��