题目内容
14.下列实验目的和操作对应不正确的是( )| 实验目的 | 实验操作 | |
| A | 检验溶液中的Fe2+离子 | 向溶液中先加入KSCN溶液,再加入氯水 |
| B | 除去Na2SO4溶液中的Na2SO3 | 向混合液中加入适量稀盐酸 |
| C | 用豆浆做豆腐 | 向煮沸的豆浆中加入盐卤(含NaCl、MgCl2、CaCl2等)溶液 |
| D | 排除SO42-对Cl-检验的干扰 | 向混合液中加入过量的Ba(NO3)2溶液,过滤后再取滤液进行检验 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.检验亚铁离子应先加KSCN,再加氯水;
B.加入盐酸引入氯离子;
C.豆浆是胶体,遇电解质发生聚沉;
D.硫酸根能与钡离子反应生成硫酸钡白色沉淀.
解答 解:A.检验亚铁离子应先加KSCN,不变色,再加氯水,变为血红色,说明有Fe2+离子,故A正确;
B.加入盐酸引入氯离子,引入了新的杂质,故B错误;
C.豆浆是胶体,遇电解质盐卤(含NaCl、MgCl2、CaCl2等)发生聚沉,故C正确;
D.硫酸根能与钡离子反应生成硫酸钡白色沉淀,NO3不影响Cl-,故D正确.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及离子的检验、除杂以及胶体的性质等,把握反应原理、物质的性质及实验技能为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
相关题目
4.化学与我们的生活息息相关,下列有关基本营养物质的说法正确的是( )
| A. | 吃馒头时越嚼越感觉甜是因为淀粉发生了水解反应 | |
| B. | 变质的油脂有难闻的哈喇味是因为油脂发生了加成反应 | |
| C. | 人体中没有水解纤维素的酶,所以纤维素在人体中没有任何作用 | |
| D. | 牛奶中含有丰富的蛋白质,所以羊毛衫上沾有奶渍时可以用加酶洗衣粉洗涤 |
5. 通过CO2电解固定技术有望减小室温效应并可得到多种燃料,其原因如图所示.下列说法中不正确的是( )
通过CO2电解固定技术有望减小室温效应并可得到多种燃料,其原因如图所示.下列说法中不正确的是( )
 通过CO2电解固定技术有望减小室温效应并可得到多种燃料,其原因如图所示.下列说法中不正确的是( )
通过CO2电解固定技术有望减小室温效应并可得到多种燃料,其原因如图所示.下列说法中不正确的是( )| A. | 阴极区溶液pH减小 | |
| B. | 当有6.72LO2(标况下)产生时转移的电子数为1.2mol | |
| C. | 电解时,生成乙烯的电极反应式是:2CO2+12e-+12H+=C2H4+4H2O | |
| D. | 该技术中能量转化方式主要有太阳能转化为电极及电能转化为化学能 |
2.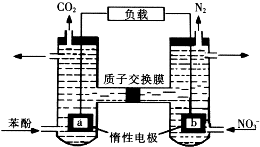 我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是
我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是
( )
 我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是
我国科学家构建了一种双室微生物燃料电池,以苯酚(C6H6O)为燃料,同时消除酸性废水中的硝酸盐.下列说法正确的是( )
| A. | a为正极 | |
| B. | 左池电极反应式为C6H6O+11H2O-28e-=6CO2↑+28H+ | |
| C. | 若右池产生0.672L气体(标况下),则转移电子0.15mol | |
| D. | 左池消耗的苯酚与右池消耗的NO${\;}_{3}^{-}$的物质的量之比为28:5 |
19.已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp[Ag2CrO4(砖红色)]=9.0×10-12,下列说法不正确的是( )
| A. | 温度相同时,溶解度大小顺序为S(Ag2CrO4)>S(AgCl)>S(AgBr) | |
| B. | 往含Cl-,Br-,CrO42-浓度均为0.01mol•L-1溶液中滴加0.01mol•L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为Br-、CrO42-、Cl- | |
| C. | 用滴定法测KNO3溶液中KCl的含量时,可选择用AgNO3溶液做标准液,Ag2CrO4溶液做指示剂 | |
| D. | 1.88gAgBr投入到100mol/LNaCl溶液中有AgCl |
6.下列装置能达到相应实验目的是( )
| A. | 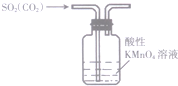 除去SO2中混有的CO2 | B. | 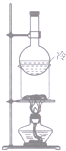 分离NH4Cl和Ca(OH)2固体 | ||
| C. | 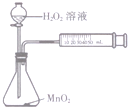 测定O2的生成速率 | D. | 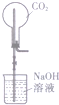 喷泉实验 |
1.第ⅤA族元素中的A、B两种元素所在周期分别最多可排18和8种元素,且B在A的上一周期,当A的原子序数为x时,B的原子序数为( )
| A. | x-18 | B. | x-8 | C. | x+8 | D. | x+18 |
2.已知甲醛(HCHO)分子中的4个原子是共平面的.下列分子中所有原子不可能同时存在于同一平面上的是( )
| A. | 苯乙烯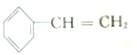 | B. | 苯甲酸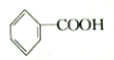 | C. | 苯甲醛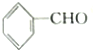 | D. | 苯乙酮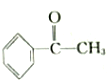 |