题目内容
8.(1)电镀是将镀件与电源的负极连接.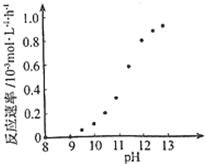
(2)化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成的镀层.
①若用铜盐进行化学镀铜,应选用还原剂(填“氧化剂”或“还原剂”)与之反应.
②某化学镀铜的反应速率随镀液pH变化如右图所示.该镀铜过程中,镀液
pH控制在12.5左右.据图中信息,给出使反应停止的方法:调节溶液的pH至8-9之间.
(3)酸浸法制取硫酸铜的流程示意图如图:
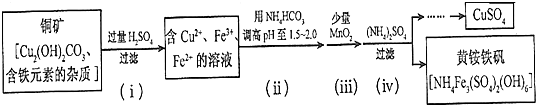
①步骤(i)中Cu2(OH)2CO3发生反应的化学方程式为Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O.
②步骤(ii)所加试剂起调节pH作用的离子是HCO3-(填离子符号).
③在步骤(iii)发生的反应中,1molMnO2转移2mol电子,该反应的离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O.
④步骤(iv)除去杂质的化学方程式可表示为3Fe3++NH4++2SO42-+6H2O═NH4Fe3(SO4)2(OH)6↓+6H+,过滤后母液的pH=2.0,c(Fe3+)=a mol•L-1,c(NH4+)=b mol•L-1,c(SO42-)=d mol•L-1,该反应的平衡常数K=$\frac{1{0}^{-12}}{{a}^{3}b{d}^{2}}$(用含a、b、d的代数式表示).
分析 (1)电镀是将镀件与电源负极相连、镀层与电源正极相连;
(2)①若用铜盐进行化学镀铜,阴极上铜离子得电子发生氧化反应,所以需要还原剂与之反应;
②根据图知,溶液的pH越大反应速率越大,可以通过控制溶液pH控制反应速率;
(3)铜矿中加入过量稀硫酸,发生的反应有Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O,溶液中金属阳离子有Cu2+、Fe2+、Fe3+,溶液呈酸性,加入碳酸氢铵,碳酸氢根离子和氢离子反应生成二氧化碳,从而增大溶液pH;向溶液中加入少量二氧化锰,酸性条件下,二氧化锰和亚铁离子反应生成铁离子、锰离子和水;向溶液中加入硫酸铵,硫酸铵和铁离子反应生成沉淀NH4Fe3(SO4)2(OH)6,采用过滤方法分离沉淀和溶液,然后通过蒸发浓缩、冷却结晶得到硫酸铜晶体,再结合题目分析解答.
解答 解:(1)电镀是将镀件与电源负极相连、镀层与电源正极相连,故答案为:负;
(2)①若用铜盐进行化学镀铜,阴极上铜离子得电子发生氧化反应,所以需要还原剂与之反应,故答案为:还原剂;
②根据图示信息,pH=8-9之间,反应速率为0,所以要使反应停止,调节溶液的pH至8-9 之间,故答案为:调节溶液的pH至8-9 之间;
(3)铜矿中加入过量稀硫酸,发生的反应有Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O,溶液中金属阳离子有Cu2+、Fe2+、Fe3+,溶液呈酸性,加入碳酸氢铵,碳酸氢根离子和氢离子反应生成二氧化碳,从而增大溶液pH;向溶液中加入少量二氧化锰,酸性条件下,二氧化锰和亚铁离子反应生成铁离子、锰离子和水;向溶液中加入硫酸铵,硫酸铵和铁离子反应生成沉淀NH4Fe3(SO4)2(OH)6,采用过滤方法分离沉淀和溶液,然后通过蒸发浓缩、冷却结晶得到硫酸铜晶体,
①碱式碳酸铜与硫酸反应生成硫酸铜、二氧化碳和水,反应方程式为Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O,
故答案为:Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O;
②题目要求调高pH,铵根离子显酸性,碳酸氢根离子显碱性,则起作用的离子是碳酸氢根离子,故答案为;HCO3-;
③依题意亚铁离子变成了铁离子,1mol MnO2转移电子2 mol,则锰元素从+4变成+2价,溶液是显酸性的,方程式经过观察可要补上氢离子,综合上述分析可写出离子方程式为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
④滤后母液的pH=2.0,则c(H+)=0.01mol/L,c(Fe3+)=a mol•L-1,c(NH4+)=b mol•L-1,c(SO42-)=d mol•L-1,该反应的平衡常数K=$\frac{{c}^{6}({H}^{+})}{{c}^{3}(F{e}^{3+}).c(N{{H}_{4}}^{+}).{c}^{2}(S{{O}_{4}}^{2-})}$=$\frac{(0.01)^{6}}{{a}^{3}×b×{d}^{2}}$=$\frac{1{0}^{-12}}{{a}^{3}b{d}^{2}}$,
故答案为:$\frac{1{0}^{-12}}{{a}^{3}b{d}^{2}}$.
点评 本题考查物质分离和提纯的综合应用及电解原理,侧重考查学生分析能力,明确流程图中发生的反应及分离方法是解本题关键,熟悉元素化合物性质及基本原理,难点是二氧化锰和亚铁离子反应方程式的书写,题目难度中等.

| A. | 氯乙烷与NaOH溶液共热,在水解后的溶液中加入硫酸,再加入AgNO3溶液检验Cl- | |
| B. | 将电石和水反应后的气体通入溴水中,如果溴水褪色,证明乙炔和溴发生了反应 | |
| C. | 实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中 | |
| D. | 向苯酚浓溶液中滴入少量浓溴水可观察到白色三溴苯酚沉淀 |
| A. | CH3-CH2-COOH | B. | CH2=CH-CH2-OH | C. | CH2=CH-COOH | D. | CH2=CH-COOCH3 |
| A. | 热稳定性:HCl>HI | B. | 原子半径:Na>Mg | ||
| C. | 酸性:H2SO4>H2SO3 | D. | 结合质子能力:Cl->S2- |
| 事实 | 推测 | |
| A | Mg与水反应缓慢,Ca与水反应较快 | Ba与水反应会更快 |
| B | Si是半导体材料,同族Ge也是半导体材料 | ⅣA族的元素都是半导体材料, |
| C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| D | Si与H2高温时反应,S与H2加热能反应 | P与H2在高温时能反应 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 新戊烷与氯气在光照条件下的取代反应 | |
| B. | 乙烯与水在一定条件下的加成反应 | |
| C. | 乙醇在空气中加热(以铜作为催化剂)的氧化反应 | |
| D. | 苯与足量的氢气在一定条件下的加成反应 |
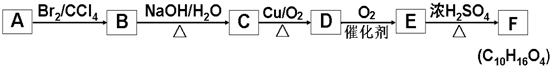
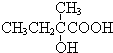
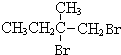 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$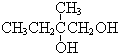 +2NaBr,反应类型取代反应
+2NaBr,反应类型取代反应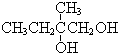 +O2+O2$\stackrel{催化剂}{→}$2
+O2+O2$\stackrel{催化剂}{→}$2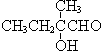 +2H2O,反应类型氧化反应
+2H2O,反应类型氧化反应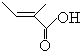 、
、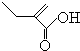 .
.