题目内容
1.一定条件下将3mol SO2和1mol O2通入体积为VL的密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g),反应前容器中的压强为P,保持温度和体积不变,5min后反应达到平衡,此时容器内混合气体的平均相对分子质量为70,则平衡时体系内压强为0.8P(用含P的代数式表示),SO2的体积分数为50%.分析 平衡时混合气体总质量等于起始时二氧化硫与氧气总质量,根据n=$\frac{m}{M}$计算平衡时混合气体总物质的量,恒温恒容条件下,压强之比等于物质的量之比;
设参加反应的SO2为xmol,利用三段式表示出平衡时各组分的物质的量,再根据平衡时混合气体总物质的量列方程计算x的值,进而计算平衡体系中SO2的体积分数.
解答 解:平衡时混合气体总质量等于起始时二氧化硫与氧气总质量,即混合气体总质量=3mol×64g/mol+1mol×32g/mol=224g,则平衡时混合气体总物质的量=$\frac{224g}{70g/mol}$=3.2mol,恒温恒容条件下,压强之比等于物质的量之比,故则平衡时体系内压强为P×$\frac{3.2mol}{3mol+1mol}$=0.8P;
设参加反应的SO2为xmol,则:
2SO2(g)+O2(g)?2SO3(g)
开始(mol):3 1 0
转化(mol):x 0.5x x
平衡(mol):3-x 1-0.5x x
所有3-x+1-0.5x+x=3.2
解得x=1.6
故平衡体系中SO2的体积分数为$\frac{1.6mol}{3.2mol}$×100%=50%,
故答案为:0.8P;50%.
点评 本题考查化学平衡的有关计算,难度不大,注意化学平衡计算中三段式的应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.由烃A经下列反应可合成G、H两种不同性能的高聚物塑料.
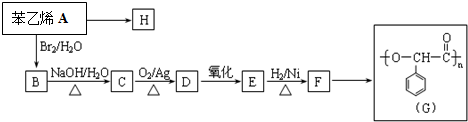
已知C的结构简式为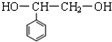 .则:
.则:
(1)高聚物H的结构简式是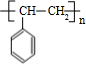 .
.
(2)写出下列反应过程的反应类型:
(3)写出C转化为D的化学方程式
(4)写出E转化为F的化学方程式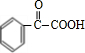 +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$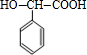 .
.

已知C的结构简式为
 .则:
.则:(1)高聚物H的结构简式是
 .
.(2)写出下列反应过程的反应类型:
| A→H | A→B | B→C | F→G | |
| 反应类型 |

(4)写出E转化为F的化学方程式
 +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$ .
.
9.要使相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中所含SO42-的数目相同,则所取两溶液的体积比是( )
| A. | 1:3 | B. | 3:1 | C. | 3:2 | D. | 2:3 |
16.1.0L KNO3和Cu(NO3)2的混合液中c(NO3-)=4.0mol•L-1.用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况下),则原混合液中c(K+)为( )
| A. | 0.5 mol•L-1 | B. | 1.0 mol•L-1 | C. | 1.5 mol•L-1 | D. | 2.0 mol•L |
13.有机物与氢气发生加成反应也叫氢化.将甲苯完全氢化后,再与氯气发生取代反应,其一氯代物的同分异构体数目有( )
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |
10.下列试剂中,属于纯净物的是( )
| A. | 稀硫酸 | B. | 石灰水 | C. | 蒸馏水 | D. | 肥皂水 |
11.下列离子方程式改写成化学方程式正确的是( )
| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-═CaCO3↓ Ca(NO3)2+Na2CO3═CaCO3↓+2NaNO3 | |
| D. | H++OH-═H2O 2KOH+H2SO4═K2SO4+2H2O |

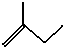
 的名称2,3,5-三甲基-4-乙基庚烷
的名称2,3,5-三甲基-4-乙基庚烷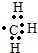 ②氢氧根离子
②氢氧根离子