题目内容
3.一种无色气体,可能是由CO2、HBr、NH3、NO2、NO、H2中的一种或几种所组成,将此无色气体通过盛有浓硫酸的洗气瓶,发现气体体积减少,继续通过装有固体Na2O2的干燥管,发现从干燥管出来的气体显红棕色.再将该气体通入盛满水倒立于水槽中的试管内,发现试管内水位上升,最后溶液充满试管.则下列推断不正确的有( )| A. | 原气体一定含有NH3、NO、CO2 | |
| B. | 原气体一定不含HBr、NO2、H2 | |
| C. | 原气体中NO与CO2的体积比一定为3:2 | |
| D. | 原气体中NO与CO2的体积比一定为2:3 |
分析 无色混合气体,说明没有NO2气体;通过浓H2SO4时,气体体积减小,说明有NH3,则一定没有HBr;通过过氧化钠后,气体呈红棕色,说明原混合气体中有CO2、NO;最后混合气体通入盛满水倒立于水槽中的试管内,发现最后试管里仍为一满试管液体,说明氧气和一氧化氮恰好全部转化为硝酸,则原混合气体中一定没有H2,据此进行判断.
解答 解:无色混合气体,说明没有NO2气体;通过浓H2SO4时,气体体积减小,说明有NH3,则一定没有HBr;通过过氧化钠后,气体呈红棕色,说明原混合气体中有CO2、NO;最后混合气体通入盛满水倒立于水槽中的试管内,发现最后试管里仍为一满试管液体,说明氧气和一氧化氮恰好全部转化为硝酸,则原混合气体中一定没有H2,
A.根据分析可知,原混合气体中一定有NH3、NO、CO2,故A正确;
B.根据分析可知,原气体一定不含HBr、NO2、H2,故B正确;
C.根据反应4NO+3O2+2H2O=4HNO3可知一氧化氮与氧气的体积比为4:3,2Na2O2+2CO2=2Na2CO3+O2 生成3体积的氧气需要6体积的二氧化碳,所以原气体中NO与CO2的体积比一定为4:6=2:3,故C错误;
D.根据C可知,原气体中NO与CO2的体积比一定为2:3,故D正确;
故选C.
点评 本题考查混合气体的组成判断,题目难度中等,明确常见气体的性质为解答关键,解答时注意从物质反应的典型现象入手判断,试题侧重考查学生的分析能力及灵活应用能力.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
13.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,16g CH4中含有10NA个电子 | |
| B. | 标准状况下,22.4 L HCl溶于水,所得溶液物质的量浓度是1.0mol/L | |
| C. | 将4gNaOH溶于100g蒸馏水,所得溶液物质的量浓度是1.0mol/L | |
| D. | 分子数为NA的CO、N2混合气体体积约为22.4 L,质量为28g |
18.下列标有横线的物质在给定条件下能完全溶解的是( )
| A. | 常温下,1mol Zn与含1mol浓硫酸反应 | |
| B. | 加热条件下,1mol Cu与含2mol浓硫酸反应 | |
| C. | 常温下,1mol Cu与含4mol浓硝酸反应 | |
| D. | 加热条件下,1mol MnO2与含4mol浓盐酸反应 |
8.自然界为人类提供了多种多样的营养物质,下列有关营养物质的说法正确的是( )
| A. | 食用纤维素、蛋白质、脂肪和植物油都是高分子化合物 | |
| B. | 棉花和蚕丝的主要成份都是纤维素 | |
| C. | 麦芽糖、淀粉、纤维素都可以发生水解反应 | |
| D. | 油脂都不能使溴水褪色 |
12.由烃A经下列反应可合成G、H两种不同性能的高聚物塑料.
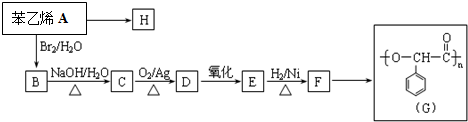
已知C的结构简式为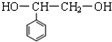 .则:
.则:
(1)高聚物H的结构简式是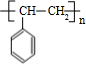 .
.
(2)写出下列反应过程的反应类型:
(3)写出C转化为D的化学方程式
(4)写出E转化为F的化学方程式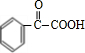 +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$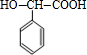 .
.

已知C的结构简式为
 .则:
.则:(1)高聚物H的结构简式是
 .
.(2)写出下列反应过程的反应类型:
| A→H | A→B | B→C | F→G | |
| 反应类型 |

(4)写出E转化为F的化学方程式
 +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$ .
.
13.有机物与氢气发生加成反应也叫氢化.将甲苯完全氢化后,再与氯气发生取代反应,其一氯代物的同分异构体数目有( )
| A. | 6种 | B. | 5种 | C. | 4种 | D. | 3种 |

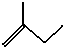
 的名称2,3,5-三甲基-4-乙基庚烷
的名称2,3,5-三甲基-4-乙基庚烷 ②氢氧根离子
②氢氧根离子
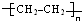 .
.