题目内容
20.已知A、B、C、D、E、G都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.G3+离子M层3d轨道电子为半满状态.请根据以上情况,回答下列问题:(1)写出G基态原子的电子排布式1s22s22p63s23p63d64s2,G位于周期表d区;画出B基态原子外围电子的电子排布图
 .
.(2)A、B、C的第一电离能由小到大的顺序为C<O<N;电负性由小到大的顺序为C<N<O.(用相应的元素符号表示)
(3)G和Mn(质子数为25)两元素的部分电离能数据列于下表:
| 元素 | Mn | G | |
| 电离能(kJ/mol) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
①Mn基态原子的外围电子排布式为3d54s2,核外电子有25种不同的运动状态,占据7种不同能量的原子轨道.
②比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态G2+再失去一个电子难,对此,合理的解释是?Mn2+的3d轨道电子排布为半满状态较稳定,而Fe2+再失去一个电子形成Fe3+的3d轨道电子排布为半满状态较稳定?.
分析 A、B、C、D、E、G都是周期表中前四周期的元素,它们的原子序数依次增大,A、C原子的L层有2个未成对电子,核外电子排布式为1s22s22p2、1s22s22p4,A的原子序数小于C,则A为C元素,C为O元素;B的原子序数介于碳、氧之间,则B为N元素;D的二价阳离子与C的阴离子具有相同的电子层结构,则D为Mg元素;D与E同主族,则E为Ca元素;G3+离子M层3d轨道电子为半满状态,则G原子核外电子排布为1s22s22p63s23d64s2,则G为Fe元素.
解答 解:A、B、C、D、E、G都是周期表中前四周期的元素,它们的原子序数依次增大,A、C原子的L层有2个未成对电子,核外电子排布式为1s22s22p2、1s22s22p4,A的原子序数小于C,则A为C元素,C为O元素;B的原子序数介于碳、氧之间,则B为N元素;D的二价阳离子与C的阴离子具有相同的电子层结构,则D为Mg元素;D与E同主族,则E为Ca元素;G3+离子M层3d轨道电子为半满状态,则G原子核外电子排布为1s22s22p63s23d64s2,则G为Fe元素.
(1)G3+离子M层3d轨道电子为半满状态,则G原子核外电子排布为1s22s22p63s23p63d64s2,G为Fe元素,位于周期表d区,B为N元素,原子外围电子排布式为2s22p3,外围电子排布图为 ,
,
故答案为:1s22s22p63s23p63d64s2;d; ;
;
(2)同周期元素从左到右元素的第一电离能呈增大趋势,由于N的2p电子为半充满状态性质稳定,则第一电离能大于O,则第一电离能C<O<N,同周期自左而右元素电负性增大,故电负性:C<N<O,
故答案为:C<O<N;C<N<O;
(3)①Mn原子核外电子数为25,原子核外电子排布式为1s22s22p63s23p63d54s2,外围电子排布式为3d54s2,核外电子没有运动状态相同的电子,核外有25种不同的运动状态,占据7种不同能量的原子轨道,
故答案为:3d54s2;7;
②Mn2+的3d轨道电子排布为半满状态较稳定,而Fe2+再失去一个电子形成Fe3+的3d轨道电子排布为半满状态较稳定,故则Mn2+再失去一个电子比气态Fe2+再失去一个电子难,
故答案为:Mn2+的3d轨道电子排布为半满状态较稳定,而Fe2+再失去一个电子形成Fe3+的3d轨道电子排布为半满状态较稳定.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、电负性等,题目难度中等,注意核外电子排布对电离能的影响.

 导学全程练创优训练系列答案
导学全程练创优训练系列答案| A. | 食用纤维素、蛋白质、脂肪和植物油都是高分子化合物 | |
| B. | 棉花和蚕丝的主要成份都是纤维素 | |
| C. | 麦芽糖、淀粉、纤维素都可以发生水解反应 | |
| D. | 油脂都不能使溴水褪色 |
| A. | 葡萄糖能与新制Cu(OH)2发生反应 | |
| B. | 肥皂是油脂在碱性条件下水解生成的 | |
| C. | “乙醇汽油”是汽油与乙醇生成的一种新型化合物 | |
| D. | 蛋白质溶液遇硫酸铜后产生的沉淀不能重新溶于水 |
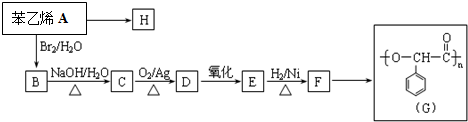
已知C的结构简式为
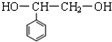 .则:
.则:(1)高聚物H的结构简式是
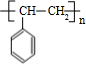 .
.(2)写出下列反应过程的反应类型:
| A→H | A→B | B→C | F→G | |
| 反应类型 |

(4)写出E转化为F的化学方程式
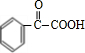 +H2$\stackrel{催化剂}{→}$
+H2$\stackrel{催化剂}{→}$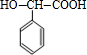 .
. | A. | 1:3 | B. | 3:1 | C. | 3:2 | D. | 2:3 |
| A. | 稀硫酸 | B. | 石灰水 | C. | 蒸馏水 | D. | 肥皂水 |

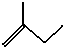
 的名称2,3,5-三甲基-4-乙基庚烷
的名称2,3,5-三甲基-4-乙基庚烷 ②氢氧根离子
②氢氧根离子
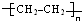 .
.