题目内容
19.将13.0g锌与足量的稀盐酸完全反应,求:(1)反应中最多可收集多少体积(标准状况下)的H2
(2)生成的氢气质量是多少克?
分析 13g锌的物质的量为0.2mol,锌与盐酸发生反应Zn+2HCl=ZnCl2+H2↑,根据方程式计算生成的氢气的物质的量,再根据V=nVm计算氢气体积,根据m=nM计算质量.
解答 解:(1)13g锌的物质的量为$\frac{13g}{65g/mol}$=0.2mol,令生成的氢气的物质的量为n,则:
Zn+2HCl=ZnCl2+H2↑
1 1
0.2mol n
所以n=0.2mol
故标准状况下生成氢气的体积为0.2mol×22.4L/mol=4.48L.
答:标准状况下最多可收集氢气4.48L.
(2)m=nM=0.2mol×2mol/L=0.4g;
答:生成的氢气质量是0.4g.
点评 本题考查了有关方程式的计算,比较基础,旨在考查学生对基础知识的掌握,掌握根据方程式计算的方法.

练习册系列答案
相关题目
9.下列中学常见实验的现象或表述正确的是( )
| A. | 过量的铁粉投入到一定量的热浓硫酸中,产生气体通入浓NaOH溶液,全部溶解 | |
| B. | 制备硅酸胶体时,向硅酸钠溶液中滴加盐酸,边加边搅拌,即可制得硅酸胶体 | |
| C. | 将分别蘸有浓硝酸和浓氨水的玻璃棒相互靠近,可产生大量白烟 | |
| D. | 向CuSO4溶液中滴入过量NaOH溶液充分反应后,将混合液体倒入蒸发皿中加热煮沸一会儿,然后冷却、过滤,滤纸上的物体为“蓝色固体” |
4.已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )


| A. | 该反应为放热反应 | B. | 该反应为吸热反应 | ||
| C. | 该反应只有在加热条件下才能进行 | D. | D物质的能量一定比A物质的能量高 |
8.自然界为人类提供了多种多样的营养物质,下列有关营养物质的说法正确的是( )
| A. | 食用纤维素、蛋白质、脂肪和植物油都是高分子化合物 | |
| B. | 棉花和蚕丝的主要成份都是纤维素 | |
| C. | 麦芽糖、淀粉、纤维素都可以发生水解反应 | |
| D. | 油脂都不能使溴水褪色 |
9.要使相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中所含SO42-的数目相同,则所取两溶液的体积比是( )
| A. | 1:3 | B. | 3:1 | C. | 3:2 | D. | 2:3 |

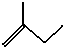
 的名称2,3,5-三甲基-4-乙基庚烷
的名称2,3,5-三甲基-4-乙基庚烷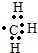 ②氢氧根离子
②氢氧根离子