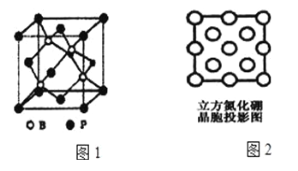
题目内容
【题目】向HCl、NH4Cl、AlCl3溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)随加入NaOH溶液体积(V)的关系正确的是( )
A. 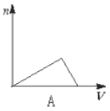 B.
B. 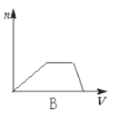
C. 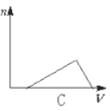 D.
D. 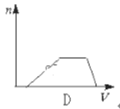
【答案】D
【解析】
向HCl、NH4Cl、AlCl3溶液中逐滴加入NaOH溶液,首先发生盐酸和氢氧化钠的中和反应,H++OH-=H2O,此时无沉淀生成;当盐酸反应完全后,在和氯化铝反应,Al3++3OH-=Al(OH)3↓,随着氢氧化钠的滴加沉淀逐渐增多,直至沉淀完全;然后发生氯化铵和氢氧化钠的反应,NH4++OH-=NH3·H2O,此时无沉淀生成,所以至氯化铵反应完全沉淀量保持不变;最后加入氢氧化钠发生反应,Al(OH)3+OH-====AlO2-+2H2O,随着氢氧化钠的滴加沉淀逐渐溶解直至消失。综上所述选项D符合所发生的变化过程;
本题答案为D。

【题目】有机物A由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 实验结论 |
(1)称取有机物A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。A分子的质谱图如下图所示:
| (1)有机物A的摩尔质量为______。 |
(2)将此9.0g A在足量纯O2充分燃烧,并使 其产物依次通过无水氯化钙、无水硫酸铜、碱石灰。实验后硫酸铜粉末没有变蓝,称量无水氯化钙增重5.4g,碱石灰增重13.2g。 | (2)经计算,有机物A的分子式为_______。 |
(3)经红外光谱测定,证实其中含有-OH和-COOH两种官能团;经核磁共振氢谱的测定,其核磁共振氢谱图如下图:
| (3)A的结构简式____________________。 |
(4)经红外光谱测定,A的一种同分异构体B中,含有与A相同的官能团。 | (4)A的同分异构体B的结构简式为:____。 |
【题目】下列说法中正确的是
A. 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
B. 25 ℃、101 kPa时,1 mol S和2 mol S的燃烧热不相等
C. 通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能
化学键 | H—H | Cl—Cl | H—Cl |
生成1 mol化学 键时放出的能量 | 436 kJ·mol-1 | 243 kJ·mol-1 | 431 kJ·mol-1 |
则1/2H2(g)+ 1/2Cl2(g)![]() HCl(g) ΔH=-183 kJ·mol-1
HCl(g) ΔH=-183 kJ·mol-1
D. 任何化学反应都伴随着能量的变化