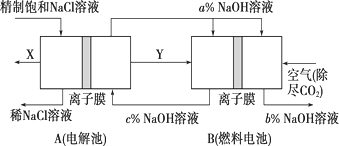
题目内容
【题目】下列说法中正确的是
A. 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
B. 25 ℃、101 kPa时,1 mol S和2 mol S的燃烧热不相等
C. 通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能
化学键 | H—H | Cl—Cl | H—Cl |
生成1 mol化学 键时放出的能量 | 436 kJ·mol-1 | 243 kJ·mol-1 | 431 kJ·mol-1 |
则1/2H2(g)+ 1/2Cl2(g)![]() HCl(g) ΔH=-183 kJ·mol-1
HCl(g) ΔH=-183 kJ·mol-1
D. 任何化学反应都伴随着能量的变化
【答案】D
【解析】
反应能否自发进行,取决于焓变和熵变的综合判据;燃烧热不随物质的量的变化而变化;反应热=反应物的总键能-生成物的总键能;化学反应的实质是旧键断裂,新键形成,断裂旧键要吸收能量,形成新键要放出能量。
反应能否自发进行,取决于焓变和熵变的综合判据,不能用焓变或熵变均可以单独作为反应自发性的判据,A错误;燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,燃烧热与反应物的多少无关,所以1mol S和2mol S的燃烧热相等,B错误;由反应热=反应物的总键能-生成物的总键能=436kJ/mol+243kJ/mol-431kJ/mol×2=-183.0kJ/mol,所以H2(g)+Cl2(g)═2HCl(g)△H=-183 kJmol-1,C错误;化学反应的实质是旧键断裂,新键形成,断裂旧键要吸收能量,形成新键要放出能量,所以任何化学反应都伴随着能量变化,故D正确。
故选D。

练习册系列答案
相关题目