题目内容
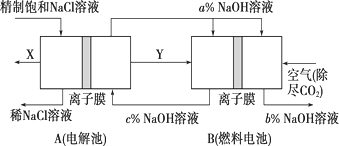
【题目】某同学设计如图装置,研究非金属元素性质变化规律。

已知:高锰酸钾在常温下与浓盐酸反应产生氯气。
(1)如果C中装饱和的H2S溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,证明氯的非金属性比硫的非金属性 ______ (填“强”或“弱”或“无法判断”)。
(2)利用如图装置证明Cl2氧化性强于I2的氧化性,则A中装浓盐酸,B中装入高锰酸钾粉末,C中装入淀粉KI溶液,则C中现象是 ______
(3)现有浓硝酸、大理石、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:非金属性:N>C>Si,C中装试剂 ______ ,实验现象为 ______ 该装置存在不足之处,改进措施为:______。
【答案】强 淀粉-KI溶液变蓝色 硅酸钠溶液 有白色沉淀生成 在B、C之间加一个盛饱和NaHCO3溶液的洗气瓶
【解析】
(1)A中装浓盐酸,B中装高锰酸钾溶液反应生成氯气具有氧化性,通入饱和氢硫酸溶液,反应开始后观察现象是C中产生淡黄色沉淀,说明氯气氧化硫化氢为硫单质;根据氧化剂的氧化性大于氧化产物,判断非金属性;
(2)利用如图装置证明氯气氧化性强于碘单质的氧化性,C中发生的是氯气和碘离子的反应生成碘单质,碘单质遇淀粉溶液变蓝;
(3)根据强酸与弱酸盐反应产生弱酸分析。
(1)如果C中装饱和氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,在B中发生反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,反应产生的氯气进入到C装置,发生反应:Cl2+H2S=S↓+2HCl,因此反应开始后观察到C中产生淡黄色沉淀,证明氯元素比硫元素非金属性强;
(2)在装置B中酸性高锰酸钾溶液与浓盐酸反应产生氯气,氯气进入到C装置中,发生反应:Cl2+2KI=2KCl+I2,I2遇淀粉溶液变为蓝色,从而证明氯元素的非金属性大于碘元素。
(3)元素的非金属性越强,其最高价氧化物对应的水化物的酸性越强,要证明元素的非金属性:N>C>Si,只需证明酸性HNO3>H2CO3>H2SiO3即可,可利用复分解反应的规律:强酸与弱酸的盐反应制取弱酸,在A(分液漏斗)中加入硝酸,在B(烧瓶)中放入大理石,在C(广口瓶)中放入硅酸钠溶液溶液,分别发生的反应是2HNO3+CaCO3=Ca(NO3)2+CO2↑+H2O、CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓,由于硅酸难溶于水,所以看到在C中出现的现象是产生白色沉淀,但由于硝酸具有挥发性,会随反应产生的CO2气体进入C装置,所以该装置存在不足之处,改进措施为:在在B、C之间加一个盛饱和NaHCO3溶液的洗气瓶,来除去CO2气体中的HNO3蒸气,以排除HNO3造成的干扰。

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案