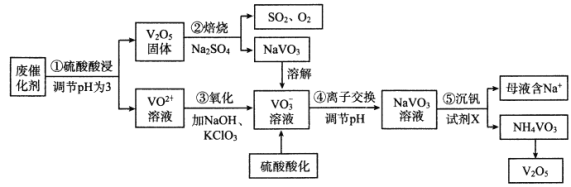
题目内容
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2,可通过二氧化碳甲醇化再利用。请回答:
(1)已知:2Al2O3(s)=4Al(g)+3O2(g)△H1=+3 351kJmol﹣1
2C(s)+O2(g)=2CO(g)△H2=﹣221kJmol﹣1
2Al(g)+N2(g)=2AlN(s)△H3=﹣318kJmol﹣1
则碳热还原Al2O3合成氮化铝的总热化学方程式为_____。
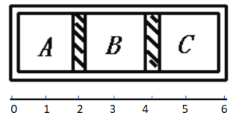
(2)在常压,Ru/TiO2催化下,CO2和H2混合气体(体积比1:4,总物质的量a mol)进行反应,测得CO2的转化率、CH4和CO的选择性随温度的变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4和CO的百分比)。
反应Ⅰ:CO2(g)+4H2(g)CH4(g)+2H2O(g)△H1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)△H2
①下列说法不正确的是_____(填序号)。
A.△H1小于零
B.温度可影响产物的选择性
C.CO2的平衡转化率随温度升高先增大后减少
D.其他条件不变将CO2和H2的初始体积比改变为1:3,可提高CO2的平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器的体积为VL.则该温度下反应Ⅰ的平衡常数为____(用a、V表示)。
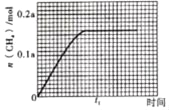
③350℃时,CH4的物质的量随时间的变化曲线如图所示。画出400℃时,0~t1时间段内,CH4的物质的量随时间的变化曲线。____
(3)CO2和H2在一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),平衡常数K=![]() .在容积为2L的密闭容器中,充入2 mol CO2和6 mol H2,恒温恒容时达到平衡。相同条件下,在另一个2 L的密闭容器中充入a mol CO2、b mol H2、c mol CH3OH、d mol H2O(g),要使两容器达到相同的平衡状态,且起始时反应逆向进行,则d的取值范围为_____。
.在容积为2L的密闭容器中,充入2 mol CO2和6 mol H2,恒温恒容时达到平衡。相同条件下,在另一个2 L的密闭容器中充入a mol CO2、b mol H2、c mol CH3OH、d mol H2O(g),要使两容器达到相同的平衡状态,且起始时反应逆向进行,则d的取值范围为_____。
(4)研究表明,CO2可以在硫酸溶液中用情性电极电解生成甲醇,则生成甲醇的电极反应式为_____。
【答案】3C(s)+Al2O3(s)+N2(g)=2AlN(s)+3CO(g)△H=△H1×![]() +△H2×
+△H2×![]() +△H3=+1026 kJmol﹣1 。 CD
+△H3=+1026 kJmol﹣1 。 CD ![]()
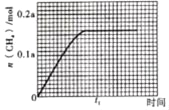 1<d<2 。 CO2+6H++6e﹣═CH3OH+H2O 。
1<d<2 。 CO2+6H++6e﹣═CH3OH+H2O 。
【解析】
(1)已知:①2Al2O3(s)=4Al(g)+3O2(g)△H1=3 351 kJmol﹣1,
②2C(s)+O2(g)=2CO(g)△H2=﹣221 kJmol﹣1,
③2Al(g)+N2(g)=2AlN(s)△H3=﹣318 kJmol﹣1,
根据盖斯定律①×![]() +②×
+②×![]() +③即得到碳热还原Al2O3合成AlN的总热化学方程式是3C(s)+Al2O3(s)+N2(g)=2AlN(s)+3CO(g)△H=△H1×
+③即得到碳热还原Al2O3合成AlN的总热化学方程式是3C(s)+Al2O3(s)+N2(g)=2AlN(s)+3CO(g)△H=△H1×![]() +△H2×
+△H2×![]() +△H3=+1026 kJmol﹣1;
+△H3=+1026 kJmol﹣1;
(2)①A、图1中,二氧化碳转化率先增大是反应正向进行,到一定温度达到平衡状态,升温平衡逆向移动,二氧化碳的转化率随温度升高而减小,说明正反应为放热反应,△H4<0,故A正确;
B、图2分析可知,图中曲线变化趋势随温度升高到400℃以上,CH4和CO选择性受温度影响,甲烷减少,一氧化碳增多,温度可影响产物的选择性,故B正确;
C、二氧化碳转化率先增大是反应正向进行未达到平衡状态,达到平衡状态后随温度升高二氧化碳转化率减小,选故C错误;
D、CO2和H2混和气体(体积比1:4,总物质的量a mol)进行反应,将CO2和H2的初始体积比改变为1:3,二氧化碳的转化率减小,故D错误;
②在常压、Ru/TiO2催化下,CO2和H2混和气体(体积比1:4,总物质的量a mol)进行反应,350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为VL,二氧化碳的转化率为80%,
CO2(g)+4H2(g)CH4(g)+2H2O(g)
起始(mol) 0.2a 0.8a 0 0
变化(mol) 0.16a 0.64a 0.16a 0.32a
平衡(mol) 0.04a 0.16a 0.16a 0.32a
反应Ⅰ的平衡常数K=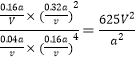 ;
;
③反应为放热反应,升高温度平衡逆向移动,二氧化碳的转化率减小,由图分析可知,接近72.5%,甲烷的物质的量减小,小于350℃时甲烷的物质的量,达到平衡所需要时间缩短,
CO2(g)+4H2(g)
起始量(mol) 0.2a 0.8a 0 0
变化量(mol) 0.145a 0.58a 0.145a 0.29a
平衡量(mol) 0.055a 0.22a 0.145a 0.29a
达到平衡状态甲烷0.145amol,升高温度加快反应速率,达到平衡所需要时间缩短,据此画出图象为: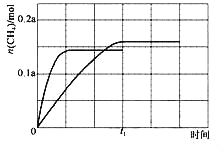 ;
;
(3)CO2和H2在一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),平衡常数K=![]() ,在容积为2L的密闭容器中,充入2 mol CO2和6 mol H2,恒温恒容时达到平衡,设平衡时转化的CO2的物质的量为x,
,在容积为2L的密闭容器中,充入2 mol CO2和6 mol H2,恒温恒容时达到平衡,设平衡时转化的CO2的物质的量为x,
CO2(g)+3H2(g)CH3OH(g)+H2O(g),
初始(mol)2 6 0 0
转化(mol)x 3x x x
平衡(mol)2﹣x 6﹣3x x x
则平衡常数K= =
=![]() ,解得:x=1,即平衡时H2O(g)的物质的量为1mol;
,解得:x=1,即平衡时H2O(g)的物质的量为1mol;
相同条件下,在另一个2L的密闭容器中充入a mol CO2、b mol H2、c mol CH3OH、d mol H2O(g),要使两容器达到相同的平衡状态,且起始时反应逆向进行,说明两个平衡互为等效平衡,则必须满足:a:b=1:3,a+d=2,c=d,当反应物只有甲醇和水时,d的物质的量最大,最大为2mol;平衡时水的物质的量为1mol,若要使平衡向逆向移动,则d>1mol,所以d的范围为:1<d<2;
(4)CO2可以在酸性水溶液中电解生成甲醇,结合电荷守恒和原子守恒配平生成甲醇的电极反应式为:CO2+6H++6e﹣═CH3OH+H2O。

【题目】工业上生产尿素的过程中会生成氨基甲酸铵![]() 。氨基甲酸铵加热时易分解,在潮湿空气中易水解。完成下列填空:
。氨基甲酸铵加热时易分解,在潮湿空气中易水解。完成下列填空:
一定温度下,n mol氨基甲酸铵在VL密闭真空容器中分解![]()
实验测得不同温度下容器内的平衡总压强如下表:
温度 |
|
|
|
|
平衡总压强 |
|
|
|
|
![]() 根据上表判断,反应中Q______
根据上表判断,反应中Q______![]() 填写“
填写“![]() ”或“
”或“![]() ”
”![]() ,判断依据是______。
,判断依据是______。
![]() 能说明该反应达到平衡状态的是______
能说明该反应达到平衡状态的是______![]() 填序号
填序号![]() 。
。
![]() 不再变化
不再变化
b.![]()
![]() 混合气体的平均分子质量不再变化
混合气体的平均分子质量不再变化
![]() 混合气体的密度不再变化
混合气体的密度不再变化
![]() 写出该反应平衡常数的表达式
写出该反应平衡常数的表达式![]() ______。
______。![]() 时,反应t分钟后固体的物质的量减少一半,t分钟内用
时,反应t分钟后固体的物质的量减少一半,t分钟内用![]() 表示的化学反应速率
表示的化学反应速率![]() ______
______![]() 。
。
氨基甲酸铵在潮湿空气中可水解得到氨水和碳酸氢铵。![]() 、
、![]() 、
、![]() 都是重要的氮肥。
都是重要的氮肥。
![]() 时,浓度均为
时,浓度均为![]() 的氨水与NaOH溶液,下列说法错误的是______。
的氨水与NaOH溶液,下列说法错误的是______。
![]() 两溶液导电能力不同
两溶液导电能力不同
b.两溶液![]() 不同
不同
![]() 两溶液中水的电离程度不同
两溶液中水的电离程度不同
![]() 两溶液中水的离子积不同
两溶液中水的离子积不同
![]() 同温度、同浓度的
同温度、同浓度的![]() 溶液和
溶液和![]() 溶液中,
溶液中,![]() 较小的是______溶液,其原因是______。
较小的是______溶液,其原因是______。
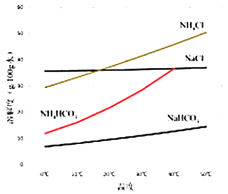
![]() 时,向一定量
时,向一定量![]() 饱和溶液中加入与溶质
饱和溶液中加入与溶质![]() 等物质的量的NaCl固体,充分反应后,根据图判断,此时溶液中离子浓度最大的是______。
等物质的量的NaCl固体,充分反应后,根据图判断,此时溶液中离子浓度最大的是______。
【题目】有A、B、C、D、E、F六种元素,它们的相关信息如下表:
元素代号 | 相关信息 |
A | 最外层的电子数是次外层电子数的3倍 |
B | 海水中含量第一位的金属元素 |
C | L层得1个电子后成为稳定结构 |
D | 二价阴离子核外有18个电子 |
E | 失去一个电子后就成为一个原子 |
F | 单质为大气中含量最多的气体 |
请填写下列空格:
(1)A原子的电子式:_______________________________。
(2)B离子的结构示意图:__________________________,与B离子质子数与电子数均相同的微粒可能是____________________________________(写出两种,用微粒符合表示)。
(3)C元素的名称:________,C原子中能量最高的电子位于第________层。
(4)D的二价阴离子的电子式:___________________________;D元素的某种同位素原子质量数为34,该原子核内的中子数为______________。
(5)A、E、F三种元素能相互形成多种类别的物质,其中属于共价化合物为________,离子化合物为________(各写出一种物质即可)