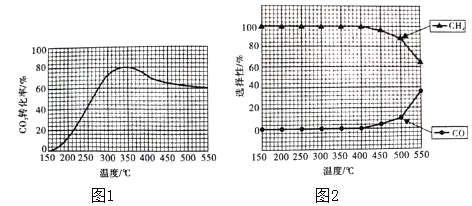
题目内容
【题目】已知H2S是一种二元弱酸,回答以下问题:
(1)0.1mol/L NaHS溶液显碱性,则c(S2-)___________c(H2S)(填“大于” ,“小于” 或“等于” ) 。
(2)常温下,向0.2 mol/L的H2S溶液中逐滴滴入0.2 mol/L NaOH溶液至中性,此时溶液中以下所示关系一定正确的是________。
A.c(H+)·c(OH-)=1×10-14
B.c(Na+)=c(HS-)+2c(S2-)
C.c(Na+) > c(HS-)+c(S2-)+c(H2S)
D.c(H2S) > c(S2-)
(3)已知常温下,CaS饱和溶液中存在平衡:CaS(s)![]() Ca2+(aq)+S2-(aq) ΔH>0。
Ca2+(aq)+S2-(aq) ΔH>0。
①温度升高时,Ksp________ (填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c(Ca2+)________,原因是______________________________________________(用文字和离子方程式说明)。
(4)若向CaS悬浊液中加入Cu(NO3)2溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式___________________________________________________________。
【答案】小于 ABD 增大 增大 针对CaS(s)![]() Ca2+(aq)+S2-(aq)平衡,加入HCl,增大H+浓度,H+与S2-结合,降低S2-浓度,导致溶解平衡正向移动 CaS (s) + Cu2+ (aq) = CuS (s) + Ca2+ (aq)
Ca2+(aq)+S2-(aq)平衡,加入HCl,增大H+浓度,H+与S2-结合,降低S2-浓度,导致溶解平衡正向移动 CaS (s) + Cu2+ (aq) = CuS (s) + Ca2+ (aq)
【解析】
(1)NaHS溶液中存在电离平衡和水解平衡:HS-![]() H++S2-和HS-+H2O
H++S2-和HS-+H2O![]() H2S+OH-,由于溶液显碱性,所以水解过程大于电离过程,则c(S2-) 小于c(H2S);综上所述,本题答案是:小于。
H2S+OH-,由于溶液显碱性,所以水解过程大于电离过程,则c(S2-) 小于c(H2S);综上所述,本题答案是:小于。
(2)A.温度不变,c(H+)·c(OH-)为常数,A正确;
B.根据电荷守恒:c(H+)+c(Na+)=c(HS-)+2c(S2-)+c(OH-),因为c(H+)=c(OH-),所以c(Na+)=c(HS-)+2c(S2-),B正确;
C.由于NaHS溶液显碱性,所以要保证溶液呈中性,H2S适当过量,所以根据物料守恒可知,c(Na+) < c(HS-)+c(S2-)+c(H2S);C错误;
D.由于NaHS溶液显碱性,所以要保证溶液呈中性,H2S适当过量,c(H2S) > c(S2-),D正确;
综上所述,本题选ABD。
(3)已知常温下,CaS饱和溶液中存在平衡:CaS(s)![]() Ca2+(aq)+S2-(aq) ΔH>0;
Ca2+(aq)+S2-(aq) ΔH>0;
①该反应正反应吸热,所以温度升高时,Ksp增大;综上所述,本题答案是:增大。
②针对CaS(s)![]() Ca2+(aq)+S2-(aq)平衡,滴加少量浓盐酸,硫离子与氢离子结合,c(S2-)减小,平衡右移,c(Ca2+)增大;综上所述,本题答案是:增大;针对CaS(s)
Ca2+(aq)+S2-(aq)平衡,滴加少量浓盐酸,硫离子与氢离子结合,c(S2-)减小,平衡右移,c(Ca2+)增大;综上所述,本题答案是:增大;针对CaS(s)![]() Ca2+(aq)+S2-(aq)平衡,加入HCl,增大H+浓度,H+与S2-结合,降低S2-浓度,导致溶解平衡正向移动。
Ca2+(aq)+S2-(aq)平衡,加入HCl,增大H+浓度,H+与S2-结合,降低S2-浓度,导致溶解平衡正向移动。
(4)CaS悬浊液存在CaS(s)![]() Ca2+(aq)+S2-(aq) 平衡,若向中加入Cu(NO3)2溶液,发生复分解反应,生成黑色固体CuS,反应的离子方程式:CaS (s) + Cu2+ (aq) = CuS (s) + Ca2+ (aq);综上所述,本题答案是:CaS (s) + Cu2+ (aq) = CuS (s) + Ca2+ (aq)。
Ca2+(aq)+S2-(aq) 平衡,若向中加入Cu(NO3)2溶液,发生复分解反应,生成黑色固体CuS,反应的离子方程式:CaS (s) + Cu2+ (aq) = CuS (s) + Ca2+ (aq);综上所述,本题答案是:CaS (s) + Cu2+ (aq) = CuS (s) + Ca2+ (aq)。

【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2在一定条件下发生反应: N2(g) +3H2(g)![]() 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=___________。平衡时H2的转化率为__________。
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=___________。平衡时H2的转化率为__________。
(2)平衡后,若提高H2的转化率,可以采取的措施有____________________。
A.加了催化剂
B.增大容器体积
C.降低反应体系的温度
D.加入一定量N2
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1_________________K2(填“<”“>”或“=” );
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(N2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g) ![]() N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________v(N2)逆(填“<”“>”或“=”)。
N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________v(N2)逆(填“<”“>”或“=”)。
【题目】25℃下,部分弱酸的电离常数如表。下列有关说法不正确的是
弱酸 | HCOOH | HClO | H2S |
电离平衡常数(Ka) | Ka=1.0×10-4 | Ka=2.0×10-8 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
A. 若 HCOONa和 HCOOH的混合溶液的pH=3,则c(HCOOH)/c(HCOO-)=10
B. 相同浓度的 HCOONa和 NaClO溶液中离子总浓度前者大
C. 任何浓度NaHS溶液中总存在:c(H2S)+c(H+)=c(OH-)+c(S2-)
D. 向 NaClO溶液中通入H2S发生的反应为2C1O-+H2S===S2-+2HClO