题目内容
【题目】工业上生产尿素的过程中会生成氨基甲酸铵![]() 。氨基甲酸铵加热时易分解,在潮湿空气中易水解。完成下列填空:
。氨基甲酸铵加热时易分解,在潮湿空气中易水解。完成下列填空:
一定温度下,n mol氨基甲酸铵在VL密闭真空容器中分解![]()
实验测得不同温度下容器内的平衡总压强如下表:
温度 |
|
|
|
|
平衡总压强 |
|
|
|
|
![]() 根据上表判断,反应中Q______
根据上表判断,反应中Q______![]() 填写“
填写“![]() ”或“
”或“![]() ”
”![]() ,判断依据是______。
,判断依据是______。
![]() 能说明该反应达到平衡状态的是______
能说明该反应达到平衡状态的是______![]() 填序号
填序号![]() 。
。
![]() 不再变化
不再变化
b.![]()
![]() 混合气体的平均分子质量不再变化
混合气体的平均分子质量不再变化
![]() 混合气体的密度不再变化
混合气体的密度不再变化
![]() 写出该反应平衡常数的表达式
写出该反应平衡常数的表达式![]() ______。
______。![]() 时,反应t分钟后固体的物质的量减少一半,t分钟内用
时,反应t分钟后固体的物质的量减少一半,t分钟内用![]() 表示的化学反应速率
表示的化学反应速率![]() ______
______![]() 。
。
氨基甲酸铵在潮湿空气中可水解得到氨水和碳酸氢铵。![]() 、
、![]() 、
、![]() 都是重要的氮肥。
都是重要的氮肥。
![]() 时,浓度均为
时,浓度均为![]() 的氨水与NaOH溶液,下列说法错误的是______。
的氨水与NaOH溶液,下列说法错误的是______。
![]() 两溶液导电能力不同
两溶液导电能力不同
b.两溶液![]() 不同
不同
![]() 两溶液中水的电离程度不同
两溶液中水的电离程度不同
![]() 两溶液中水的离子积不同
两溶液中水的离子积不同
![]() 同温度、同浓度的
同温度、同浓度的![]() 溶液和
溶液和![]() 溶液中,
溶液中,![]() 较小的是______溶液,其原因是______。
较小的是______溶液,其原因是______。
![]() 时,向一定量
时,向一定量![]() 饱和溶液中加入与溶质
饱和溶液中加入与溶质![]() 等物质的量的NaCl固体,充分反应后,根据图判断,此时溶液中离子浓度最大的是______。
等物质的量的NaCl固体,充分反应后,根据图判断,此时溶液中离子浓度最大的是______。

【答案】![]() 随温度升高,平衡总压增大,说明升温平衡正反应方向移动正反应为吸热反应 d
随温度升高,平衡总压增大,说明升温平衡正反应方向移动正反应为吸热反应 d ![]()
![]() d
d ![]() 两溶液中都存在铵根离子水解,但碳酸氢铵中碳酸氢根离子和铵根离子水解相互促进,水解平衡正向进行,水解程度增大,剩余铵根离子浓度减小
两溶液中都存在铵根离子水解,但碳酸氢铵中碳酸氢根离子和铵根离子水解相互促进,水解平衡正向进行,水解程度增大,剩余铵根离子浓度减小 ![]()
【解析】
(1)图表分析可知,随温度升高,平衡总压增大,说明升温平衡正反应方向移动,该反应的正反应为吸热反应,反应中![]() ,
,![]() ;
;
(2)a、根据反应方程式,反应物为固体,产物为气体,反应任何时候,c(NH3)/c(CO2)始终保持不变,即该比值保持保持不变,不能说明反应达到平衡状态,故a不符合题意;
b、没有说明速率的方向,因此不能据此判断是否达到平衡,故b不符合题意;
c、根据反应方程式的特点,混合气体的平均分子质量始终不再变化,不能说明反应达到平衡状态,故c不符合题意;
d、根据密度的定义,反应物为固体,生成物为气体,随着反应进行,气体质量增大,容器为恒容,气体体积不变,因此混合气体的密度不再变化说明反应达到平衡状态,故d正确;
(3)反应中![]() ,根据化学平衡常数的定义,平衡常数
,根据化学平衡常数的定义,平衡常数![]() ;
;![]() 时,反应t分钟后固体的物质的量减少一半,即反应物消耗
时,反应t分钟后固体的物质的量减少一半,即反应物消耗![]() ,生成氨气物质的量为nmol,t分钟内用
,生成氨气物质的量为nmol,t分钟内用![]() 表示的化学反应速率
表示的化学反应速率![]() ;
;
(4)a、NH3·H2O为弱电解质,部分电离,NaOH为强碱,完全电离,则两溶液中离子浓度不同,导电能力不同,故a说法正确;
b、一水合氨溶液中存在电离平衡,氢氧化钠为强电解质完全电离,两溶液![]() 不同,故b说法正确;
不同,故b说法正确;
c、溶液中氢氧根离子浓度不同,对水抑制程度不同,两溶液中水的电离程度不同,故c说法正确;
d、水的离子积只受温度的影响,温度不变,则两溶液中水的离子积相同,故d说法错误;
(5)同温度、同浓度的![]() 溶液和
溶液和![]() 溶液中,NH4Cl溶液中存在NH4++H2O
溶液中,NH4Cl溶液中存在NH4++H2O![]() NH3·H2O+H+,NH4HCO3属于弱酸弱碱盐,NH4HCO3相当于在NH4Cl溶液中加入HCO3-,促进NH4+的水解,则c(NH4+)最小的是NH4HCO3,其原因是两溶液中都存在铵根离子水解,但碳酸氢铵中碳酸氢根离子和铵根离子水解相互促进,水解平衡正向进行,水解程度增大,剩余铵根离子浓度减小;
NH3·H2O+H+,NH4HCO3属于弱酸弱碱盐,NH4HCO3相当于在NH4Cl溶液中加入HCO3-,促进NH4+的水解,则c(NH4+)最小的是NH4HCO3,其原因是两溶液中都存在铵根离子水解,但碳酸氢铵中碳酸氢根离子和铵根离子水解相互促进,水解平衡正向进行,水解程度增大,剩余铵根离子浓度减小;
(6)25℃时,向一定量![]() 饱和溶液中加入与溶质
饱和溶液中加入与溶质![]() 等物质的量的NaCl固体,溶解后结合溶解度大小,得到析出碳酸氢钠晶体,则溶液中离子浓度最大的是氯离子;
等物质的量的NaCl固体,溶解后结合溶解度大小,得到析出碳酸氢钠晶体,则溶液中离子浓度最大的是氯离子;

【题目】合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。

①图A中氨气的体积分数为15%时,H2的转化率为_______。
②图B中T=500℃,则温度为450℃时对应的曲线是_______(填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
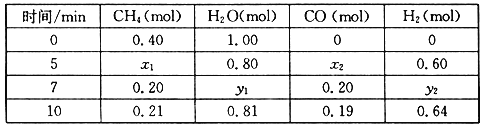
①分析表中数据,判断5 min时反应是否处于平衡状态?_____(填“是”或“否”)。
②该温度下,上述反应的平衡常数K=_____________________。
③反应在7~10 min内,CO的物质的量减少的原因可能是____________(填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是___________。
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
气化反应式 | lgK | ||
700K | 900K | 1200K | |
C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
则反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______。
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______。
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)![]() pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/molL-1 | 0.08 | 0.20 | 0.44 |
①当压强从2×105Pa增加到5×105Pa时,平衡______移动(填“正向、逆向或不”)。
②当压强为1×106Pa时,此反应的平衡常数表达式为______________。