题目内容
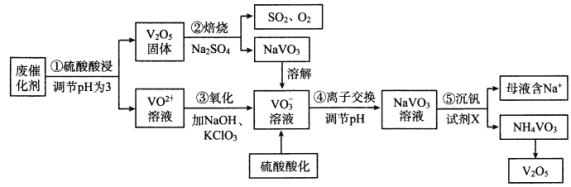
【题目】钒是一种重要的金属材料,其用途之一是制备催化剂,如接触法生产硫酸中使用的催化剂(主要成分V2O5、V2O4)。利用废催化剂回收制备V2O5的工艺流程如下:
已知:20℃时,NH4VO3的Ksp=1.68×10-2
回答下列问题:
(1)步骤①为提高浸取效率采取的方法有___________(任写两条)
(2)步骤②中反应的氧化剂是___________。
(3)步骤③中ClO3-被还原为Cl-,该反应的离子方程式为__________。
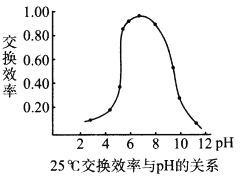
(4)步骤④中,离子交换效率与pH的关系如右图,为提高交换效率应控制的pH范围是___________。
(5)步骤⑤所发生反应的离子方程式为___________。若母液中NH4+的浓度为1.0mol/L,则c(VO3-)=___________。
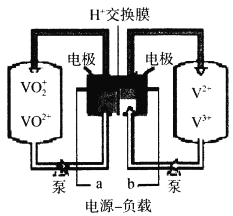
(6)全钒电池是以溶解在一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、VO2+)为电极反应的活性物质。一种全钒电池原理如下图,放电时H+从右向左移动。写出充电时阳极的电极反应式___________,当转移0.1mol电子时,转移H+的物质的量为___________mol。
【答案】粉碎废催化剂、升高浸取温度或搅拌等 Na2SO4 6VO2++ClO3-+180H-=6VO3-+Cl-+9H2O 6![]() 8 NH4++VO3-=NH4VO3↓ 1.68
8 NH4++VO3-=NH4VO3↓ 1.68![]() 10-2mol/L VO2++H2O-e-=VO2++2H+ 0.1
10-2mol/L VO2++H2O-e-=VO2++2H+ 0.1
【解析】
(1)提高浸取的速率可以提高浸取的效率,因此,可采用增大接触面积(粉碎废催化剂)、升高浸取温度或搅拌等手段。答案:粉碎废催化剂、升高浸取温度或搅拌等。
(2)步骤②中的反应方程式为:2V2O5+2Na2SO4=4NaVO3+2SO2↑+O2↑,根据化合价变化判断只有S![]() ,化合价降低,发生了还原反应,O:-2
,化合价降低,发生了还原反应,O:-2![]() 0化合价升高了,发生了氧化反应,所以氧化剂为Na2SO4;答案:Na2SO4。
0化合价升高了,发生了氧化反应,所以氧化剂为Na2SO4;答案:Na2SO4。
(3)分析参与氧化还原反应的离子,根据电子转移守恒配平,考虑反应条件为碱性环境,反应前加OH-,反应后生成水。即为:6VO2+十ClO3-十180H-=6VO3-+Cl-+9H20。
(4)从图中可知pH为6![]() 8时交换效率最高。答案:6
8时交换效率最高。答案:6![]() 8。
8。
(5)由框图知,由NaVO3经沉钒得生成物NH4VO3知,此反应的离子反应方程式:NH4++ VO3- =NH4VO3↓,已知:20℃时,NH4VO3的Ksp=1.68×10-2,NH4+的浓度为1.0mol/L,代入溶度积常数的表达式c(NH4+)![]() c(VO3-)=1.68×10-2,所以c(VO3-)=1.68×10-2mol/L。答案:1.68×10-2 mol/L。
c(VO3-)=1.68×10-2,所以c(VO3-)=1.68×10-2mol/L。答案:1.68×10-2 mol/L。
(6)放电时H+从右向左移动,则充电时H+从左向右移动,表明电解池(充电时)的阳极为左泵、阴极为右泵,所以阳极反应为VO2++H2O-e-=VO2++2H+。答案:VO2++H2O-e-=VO2++2H+。
当外电路转移0.1mol电子时,根据电量守恒可知溶液中必转移0.1molH+。在阳极有0.1molVOSO4变为了0.05mol(VO2)2SO4+0.05molSO42-,产生的0.2molH+将有0.1mol匹配SO42-,0.1mol移向右泵(阴极)。答案:0.1

【题目】合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。

①图A中氨气的体积分数为15%时,H2的转化率为_______。
②图B中T=500℃,则温度为450℃时对应的曲线是_______(填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
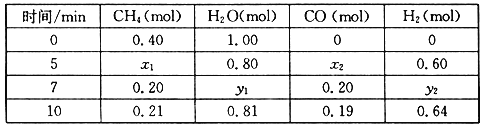
①分析表中数据,判断5 min时反应是否处于平衡状态?_____(填“是”或“否”)。
②该温度下,上述反应的平衡常数K=_____________________。
③反应在7~10 min内,CO的物质的量减少的原因可能是____________(填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是___________。
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
气化反应式 | lgK | ||
700K | 900K | 1200K | |
C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
则反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______。
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______。
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)![]() pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/molL-1 | 0.08 | 0.20 | 0.44 |
①当压强从2×105Pa增加到5×105Pa时,平衡______移动(填“正向、逆向或不”)。
②当压强为1×106Pa时,此反应的平衡常数表达式为______________。