题目内容
【题目】有A、B、C、D、E、F六种元素,它们的相关信息如下表:
元素代号 | 相关信息 |
A | 最外层的电子数是次外层电子数的3倍 |
B | 海水中含量第一位的金属元素 |
C | L层得1个电子后成为稳定结构 |
D | 二价阴离子核外有18个电子 |
E | 失去一个电子后就成为一个原子 |
F | 单质为大气中含量最多的气体 |
请填写下列空格:
(1)A原子的电子式:_______________________________。
(2)B离子的结构示意图:__________________________,与B离子质子数与电子数均相同的微粒可能是____________________________________(写出两种,用微粒符合表示)。
(3)C元素的名称:________,C原子中能量最高的电子位于第________层。
(4)D的二价阴离子的电子式:___________________________;D元素的某种同位素原子质量数为34,该原子核内的中子数为______________。
(5)A、E、F三种元素能相互形成多种类别的物质,其中属于共价化合物为________,离子化合物为________(各写出一种物质即可)
【答案】![]()
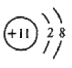 NH4+、H3O+ 氟 略
NH4+、H3O+ 氟 略 ![]() 18 HNO3 NH4NO3
18 HNO3 NH4NO3
【解析】
A最外层的电子数是次外层电子数的3倍,则A为O元素;海水中含量第一位的金属元素是钠,则B为Na元素;L层得1个电子后成为稳定结构,说明该原子最外层有7个电子,C为F元素;二价阴离子核外有18个电子,则D原子核内有16个质子,D为S元素;E失去一个电子后就成为一个质子,则E为H元素;F的单质为大气中含量最多的气体,则F为N元素。
(1)A为O元素,原子的电子式:![]() ,
,
答案为:![]() 。
。
(2)B为Na元素,钠离子的结构示意图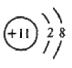 ,与钠离子质子数与电子数均相同的微粒可能是NH4+、H3O+,
,与钠离子质子数与电子数均相同的微粒可能是NH4+、H3O+,
答案为: ;NH4+、H3O+。
;NH4+、H3O+。
(3)C为F元素,名称为氟,氟原子有两个电子层,能量最高的电子位于第L层。
答案为:L。
(4)D为S元素,S的二价阴离子是S2-,电子式为![]() ;S元素的某种同位素原子质量数为34,S的质子数为16,则原子核内的中子数为34-16=18。
;S元素的某种同位素原子质量数为34,S的质子数为16,则原子核内的中子数为34-16=18。
答案为:.![]() ;18。
;18。
(5)A、E、F三种元素分别为O、H、N,能相互形成多种类别的物质,其中属于共价化合物为HNO3,离子化合物为NH4NO3;
答案为:HNO3 ;NH4NO3。

【题目】常温下,下列各组物质中,Y既能与X反应又能与Z反应的是( )
X | Y | Z | |
① | NaOH溶液 | Al(OH)3 | 稀硫酸 |
② | NaOH溶液 | SiO2 | 浓盐酸 |
③ | O2 | N2 | H2 |
④ | FeCl3溶液 | Cu | 浓硝酸 |
A.①③B.②④C.①④D.②③
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2在一定条件下发生反应: N2(g) +3H2(g)![]() 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=___________。平衡时H2的转化率为__________。
2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=___________。平衡时H2的转化率为__________。
(2)平衡后,若提高H2的转化率,可以采取的措施有____________________。
A.加了催化剂
B.增大容器体积
C.降低反应体系的温度
D.加入一定量N2
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:
N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1_________________K2(填“<”“>”或“=” );
②下列各项能作为判断该反应达到化学平衡状态的依据是_______(填序号字母)
A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.v(H2)正=3v(N2)逆
C.容器内压强保持不变
D.混合气体的密度保持不变
③400℃时,反应2NH3(g) ![]() N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________v(N2)逆(填“<”“>”或“=”)。
N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正________v(N2)逆(填“<”“>”或“=”)。