��Ŀ����
����Ŀ����֪��ӦA(g)![]() B(g) 2C(g)��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
B(g) 2C(g)��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
�¶�/�� | 700 | 800 | 830 | 1000 | 1200 |
ƽ�ⳣ�� | 1.70 | 1.10 | 1.00 | 0.60 | 0.40 |
�ش��������⣺
(1)�÷�Ӧ��ƽ�ⳣ������ʽK![]() ____________��
____________��![]() ______0(�������������������P��)
______0(�������������������P��)
(2)�ݻ��̶����жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊ_______(����ȷѡ��ǰ����ĸ)��
a��������ܶȲ���ʱ��ı�
b��![]() (A)����ʱ��ı�
(A)����ʱ��ı�
c���������ƽ����Է�����������ʱ��ı�
d��ѹǿ����ʱ��ı�
(3)1200��ʱ��Ӧ2C(g) ![]() A(g)
A(g)![]() B(g)��ƽ�ⳣ��ֵΪ____________��
B(g)��ƽ�ⳣ��ֵΪ____________��
(4)830��ʱ����һ��10.00L���ܱ������г���0.40 mol��A��1.60 mol��B�������Ӧ��ʼ2s������C�����ʵ���Ϊ0.40 mol����2s��A��ƽ����Ӧ����![]() (A)=____________
(A)=____________
mol��L��1��s��1��2sʱ![]() (B)= ___________mol��L��1��2sʱA��ת����Ϊ___________��2sʱC���������Ϊ_______________��
(B)= ___________mol��L��1��2sʱA��ת����Ϊ___________��2sʱC���������Ϊ_______________��
���𰸡���1��![]() ��1�֣� �� ��1�֣�
��1�֣� �� ��1�֣�
��2��b(1��)
��3��2�� 50(1��)
��4�� 0��010 ��1�֣� 0��14 ��1�֣� 0��50 ��1�֣� 20%��1�֣�
��������
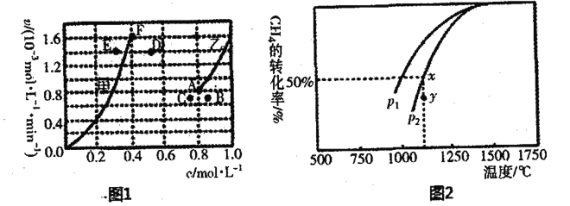
���⣨1���¶�Խ�ߣ�ƽ�ⳣ��ԽС�����������¶ȣ�ƽ�������ƶ��������Ƿ��ȷ�Ӧ��
��2�� �ݻ��̶����÷�Ӧ�з�Ӧ��������ﶼ�����壬����һ������������ƽ����������ڵ������ܶȶ�������ʱ��ı䡣��Ӧǰ������ķ�����Ϊ�䣬����һ������Щ��������ƽ����Է�����������ƽ�������ʱ��ı䡣�������ڷ�Ӧǰ�� ���䣬���ѹǿʼ�ղ��䡣
��3����ƽ���ƽ�ⳣ��Ϊ����1200��ʱ��ƽ�ⳣ���ĵ�����
��4���������֪v(C)= 0��02mol��L-1��s-1������v(A)= 0��01mol��L-1��s-1��
A(g) + B(g)![]() 2 C(g)
2 C(g)
��ʼ�� 0��40mol 1��60mol 0
ת���� 0��20mol 0��20mol 0��40mol
ƽ�⣺ 0��20mol 1��40mol 0��40mol
C���������Ҳ����C�����ʵ���������Ϊ:![]()

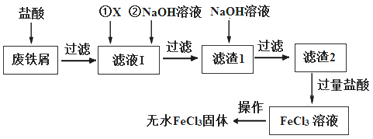
����Ŀ�����Ȼ�����ӡˢ��ҽҩ�����ϡ���ˮ�����Լ��л��ϳɴ�����������Ҫ��Ӧ�á���ҵ�ϳ��Է���м������SiO2��Al2O3��MgO��Fe2O3�����ʣ�Ϊԭ���Ʊ��Ȼ�����������������ͼ��
��֪�����������Ksp�±���
�������� | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
Ksp | 1.0��10-36 | 1.6��10-14 | 2.0��10-33 | 1.2��10-11 |
��ش��������⣺
��1������X���ѡ�����������е�____��ѡ����ţ�������X��Ŀ����_________��
A��KMnO4 B��FeCl3 C��H2O2 D��HNO3
��2����Һ�����NaOH��Һ��Ŀ���ǵ�����Һ��pH����֪��Һ����c(Fe3+)Ϊ1.0mol��L-1��c(Al3+)Ϊ0.03mol��L-1����Fe3+������ȫʱ��c(Fe3+)Ϊ1��10-5mol��L-1����Al3+�Ƿ��Ѿ���ʼ��������ͨ������˵��______________��
��3��д������1��NaOH��Һ��Ӧ�����ӷ���ʽ_____________________��
��4������2�мӹ��������Ŀ����_____________________________��
��5��FeCl3���о�ˮ���ã�����ʴ�豸�����ۺ��Ȼ�����һ�����͵���������������ˮ��FeCl3��Ч���Ҹ�ʴ��С��
��FeCl3��ˮ��ԭ����________��FeCl3��Һ��ʴ�����豸����H�������⣬��һ��Ҫԭ���ǣ������ӷ���ʽ��ʾ��_________��
��FeCl3����Һ�з�����ˮ�⣺Fe3����H2O![]() Fe(OH)2����H����K1��Fe(OH)2����H2O
Fe(OH)2����H����K1��Fe(OH)2����H2O![]() Fe(OH)2+��H����K2��Fe(OH)2+��H2O
Fe(OH)2+��H����K2��Fe(OH)2+��H2O![]() Fe(OH)3��H����K3������ˮ�ⷴӦ��ƽ�ⳣ��K1��K2��K3�ɴ�С��˳����_______��
Fe(OH)3��H����K3������ˮ�ⷴӦ��ƽ�ⳣ��K1��K2��K3�ɴ�С��˳����_______��
��ͨ����������������ˮ�����ۺϣ����ɾۺ��Ȼ��������ӷ���ʽΪxFe3����yH2O![]() Fex(OH)y(3x-y)+��yH������ʹƽ�������ƶ��ɲ��õķ����ǣ�����ţ�_____��
Fex(OH)y(3x-y)+��yH������ʹƽ�������ƶ��ɲ��õķ����ǣ�����ţ�_____��
a�����¡� b����ˮϡ�� c������NH4Cl d������NaHCO3
�����£�ʹ�Ȼ�����Һת��Ϊ��Ũ�Ⱦۺ��Ȼ����Ĺؼ�������___________��