题目内容
【题目】(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,反应的化学方程式_____________漂白粉的有效成分是__________(填化学式)。
(2)实验室制取氨气的化学方程式:__________________________________
(3)1.2gRSO4中含0.01molR2+,则RSO4的摩尔质量是______________;
(4)实验室制Fe(OH)2一般看不到白色的Fe(OH)2沉淀,原因___________________现象是:_________________________ 。反应的化学方程式:__________________________________
(5)碳酸钠水解反应的离子方程式(第一步):_________________________ 。
(6)铅蓄电池的负极反应式:_________________________ 。
(7)硫酸钡的沉淀溶解平衡:__________________________________。
【答案】2Cl2 + 2Ca(OH)2 = Ca(ClO)2 + CaCl2 +2 H2O Ca(ClO)2 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 120g/mol Fe(OH)2被空气中的氧气氧化 白色沉淀迅速变灰绿色最后变红褐色 反应的化学方程式:4Fe(OH)2+O2+2 H2O=4Fe(OH)3 CO32-+ H2O
CaCl2+2NH3↑+2H2O 120g/mol Fe(OH)2被空气中的氧气氧化 白色沉淀迅速变灰绿色最后变红褐色 反应的化学方程式:4Fe(OH)2+O2+2 H2O=4Fe(OH)3 CO32-+ H2O![]() OH-+H CO3- Pb-2e-+SO42-=PbSO4 BaSO4(s)
OH-+H CO3- Pb-2e-+SO42-=PbSO4 BaSO4(s) ![]() Ba2+ (aq)+SO42-(aq)
Ba2+ (aq)+SO42-(aq)
【解析】
(1)工业上将氯气通入石灰乳制取漂白粉,氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应方程式为2Cl2+2Ca(OH)2=Ca(ClO)2 +CaCl2+2H2O,次氯酸盐是漂白杀毒剂的有效成分,漂白粉的有效成分是Ca(ClO)2,故答案为:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,Ca(ClO)2。
(2)实验室用氯化铵和消石灰反应生成氨气和氯化钙、水,反应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
(3)1.2gRSO4中含0.01molR2+,根据公式n=m/M,则RSO4
的M=m/n=1.2g/0.01mol=120g/mol,RSO4的摩尔质量在数值上等于其相对分子质量,所以RSO4的摩尔质量为120g/mol,故答案为:120g/mol。
(4)实验室制Fe(OH)2一般看不到白色的Fe(OH)2沉淀,因为Fe(OH)2被空气中的氧气氧化,现象为:白色沉淀迅速变为灰绿色最后变为红褐色,反应的化学方程式:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:Fe(OH)2被空气中的氧气氧化,白色沉淀迅速变为灰绿色最后变为红褐色,4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(5)碳酸钠为强碱弱酸盐,水解呈碱性,且以第一步水解为主,水解方程式为CO32-+H2O![]() HCO3-+OH-,故答案为:CO32-+H2O
HCO3-+OH-,故答案为:CO32-+H2O![]() HCO3-+OH-。
HCO3-+OH-。
(6)由铅蓄电池的总反应PbO2+2H2SO4+Pb═2PbSO4+2H2O可知,放电时,Pb被氧化,应为电池负极反应,电极反应式为Pb-2e-+SO42-=PbSO4,故答案为:Pb-2e-+SO42-=PbSO4。
(7)硫酸钡在水中存在沉淀溶解平衡:BaSO4(s)![]() Ba2+(aq)+SO42-(aq),故答案为:BaSO4(s)
Ba2+(aq)+SO42-(aq),故答案为:BaSO4(s)![]() Ba2+(aq)+SO42-(aq)。
Ba2+(aq)+SO42-(aq)。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】已知反应A(g)![]() B(g) 2C(g)的平衡常数和温度的关系如下:
B(g) 2C(g)的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.70 | 1.10 | 1.00 | 0.60 | 0.40 |
回答下列问题:
(1)该反应的平衡常数表达式K![]() ____________,
____________,![]() ______0(填“﹤”“﹥”或“≒”)
______0(填“﹤”“﹥”或“≒”)
(2)容积固定,判断该反应是否达到平衡的依据为_______(填正确选项前的字母)。
a.气体的密度不随时间改变
b.![]() (A)不随时间改变
(A)不随时间改变
c.混合气体平均相对分子质量不随时间改变
d.压强不随时间改变
(3)1200℃时反应2C(g) ![]() A(g)
A(g)![]() B(g)的平衡常数值为____________。
B(g)的平衡常数值为____________。
(4)830℃时,向一个10.00L的密闭容器中充入0.40 mol的A和1.60 mol的B,如果反应初始2s内生成C的物质的量为0.40 mol,则2s内A的平均反应速率![]() (A)=____________
(A)=____________
mol·L-1·s-1;2s时![]() (B)= ___________mol·L-1;2s时A的转化率为___________;2s时C的体积分数为_______________。
(B)= ___________mol·L-1;2s时A的转化率为___________;2s时C的体积分数为_______________。
【题目】金属钒熔点高、硬度大,具有良好的可塑性和低温抗腐蚀性.工业常用钒炉渣(主要含FeO·V2O3,还有少量Al2O3、CuO等杂质)提取金属钒,流程如图:

已知:
I.钒有多种价态,其中+5价最稳定.钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡:VO2++H2OVO3+2H+.
Ⅱ.部分离子的沉淀pH:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀PH | 5.2 | 7.6 | 2.7 |
完全沉淀PH | 6.4 | 9.6 | 3.7 |
回答下列问题
(1)碱浸步骤中最好选用______________(填字母)
a. NaOH溶液 b.氨水c.纯碱溶液
(2)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,其中铁元素全部转化为+3价的氧化物,写出该反应的化学方程式___________________________________
(3)溶液1到溶液2的过程中,调节pH至8有两个目的,一是除去________离子,二是促使_________.
(4)沉钒过程中得到NH4VO3沉淀需要洗涤,写出实验室洗涤的操作方法____________________.
(5)常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式____________________________.
(6)钒的化合物也有广泛的用途,如一种新型铝离子可充电电池的结构如图所示.
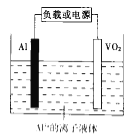
已知放电时电池反应为xAl+VO2=AlxVO2↓,则放电时正极的电极反应式为_____________________.