题目内容
【题目】下列关于有机化合物的说法正确的是
A. 分子式为C3H6Cl2的有机物有4种同分异构体(不考虑立体异构)
B. ![]() 和
和![]() 互为同系物
互为同系物
C. 乙炔和溴的四氯化碳溶液反应生成1,2-二溴乙烷
D. 甲苯分子中所有原子都在同一平面上
【答案】A
【解析】A.当两个Cl原子在同一碳原子上时,存在两种同分异构体:CH(Cl)2CH2CH3、CH3C(Cl)2CH3,当两个Cl原子位于不同C原子时,也存在两种结构:CH2ClCHClCH3、CH2ClCH2CH2Cl,所以分子式为C3H6Cl2的有机物总共含有4种结构,故A正确;B.![]() 和
和![]() 的结构不相似,不属于同系物,故B错误;C.乙炔含碳碳三键,则与溴的四氯化碳溶液发生加成反应生成1,1,2,2-四溴乙烷,故C错误;D.由于甲苯中甲基为四面体结构,所以甲苯中所有原子不可能共平面,故D错误;故选A。
的结构不相似,不属于同系物,故B错误;C.乙炔含碳碳三键,则与溴的四氯化碳溶液发生加成反应生成1,1,2,2-四溴乙烷,故C错误;D.由于甲苯中甲基为四面体结构,所以甲苯中所有原子不可能共平面,故D错误;故选A。

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】r—Fe2O3是一种具有磁性、催化、气敏的纳米材料。一种以硫铁矿烧渣等为原料制备r—Fe2O3的流程如下:

(1)下列有关“还原焙烧”工序的说法正确的是_____(填字母)。
a.焦炭应少量,空气应过量
b. 焙烧过程均为吸热反应,需用电炉持续加热反应器
c.“还原焙烧”的主要反应为 3C+2O2![]() 2CO+CO2、Fe2O3+CO
2CO+CO2、Fe2O3+CO![]() 2FeO+CO2
2FeO+CO2
(2)“浸取”前需将焙烧生成的熔体粉碎,其目的是_____________________。
(3)已知三种金属离子开始沉淀和完全沉淀的pH如下表:
Fe3+ | Fe2+ | Al3+ | |
开始沉淀的pH | 2.2 | 7.5 | 4.1 |
完全沉淀的pH | 3.5 | 9.5 | 5.4 |
则“调pH”时,溶液的pH范围为_______________。
(4)滤渣1的主要成分为_________(填化学式);“沉铁”时发生反应的离子方程式为___________。
(5)“过滤2”时需用蒸馏水洗涤,能证明沉淀已洗涤干净的方法是_________;沉淀缓慢氧化为铁黄的化学方程式为________________。
【题目】按要求完成下列各小题
(1)写出NaHSO4在水溶液中的电离方程式______________________________________。
(2)氯化铝的水溶液常温时呈_____(填“酸”、“中”、“碱”)性,把氯化铝溶液蒸干,灼烧,最后得到的固体产物是__________。
(3)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是___________________(用离子方程式和适当文字说明);配制完毕后要加入少量铁屑,其目的是____________________________。
(4)t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw=________________;
②在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液的pH= _____________。
【答案】 NaHSO4=Na++H++SO42- 酸 Al2O3 Fe2++2H2OFe(OH)2+2H+ 抑制Fe2+水解 防止Fe2+氧化 1.0×10-12 11
【解析】(1). NaHSO4是强酸的酸式盐,在水溶液中完全电离,电离方程式为:NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-;
(2).AlCl3是强酸弱碱盐,水解使溶液呈酸性;Al3++3H2O![]() Al(OH)3+3H+,加热蒸干氯化铝溶液,促进铝离子的水解,使平衡正向移动,因HCl易挥发,则蒸干后得到Al(OH)3固体,灼烧时Al(OH)3发生分解:2Al(OH)3
Al(OH)3+3H+,加热蒸干氯化铝溶液,促进铝离子的水解,使平衡正向移动,因HCl易挥发,则蒸干后得到Al(OH)3固体,灼烧时Al(OH)3发生分解:2Al(OH)3 ![]() Al2O3+3H2O,所以灼烧后得到氧化铝固体,故答案为:酸;Al2O3;
Al2O3+3H2O,所以灼烧后得到氧化铝固体,故答案为:酸;Al2O3;
(3).实验室配制FeSO4溶液,因亚铁离子发生水解:Fe2++2H2O![]() Fe(OH)2+2H+,则溶解时先加入少量的稀硫酸,增大氢离子浓度,抑制Fe2+水解;因Fe2+容易被空气中的氧气氧化为Fe3+,配制完毕后加入少量铁屑,可以发生:Fe+2Fe3+=3Fe2+,从而达到防止Fe2+被氧化的作用,故答案为:Fe2++2H2O
Fe(OH)2+2H+,则溶解时先加入少量的稀硫酸,增大氢离子浓度,抑制Fe2+水解;因Fe2+容易被空气中的氧气氧化为Fe3+,配制完毕后加入少量铁屑,可以发生:Fe+2Fe3+=3Fe2+,从而达到防止Fe2+被氧化的作用,故答案为:Fe2++2H2O![]() Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
Fe(OH)2+2H+,抑制Fe2+水解;防止Fe2+氧化;
(4).① . t℃时,某NaOH稀溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,则Kw= c(H+)×c(OH-)= 10-a mol·L-1×10-b mol·L-1=1.0×10-(a+b),已知a+b=12,则Kw=1.0×10-12,故答案为:1.0×10-12;
②在该温度下,100mL 0.1 mol·L-1的稀H2SO4溶液中n(H+)=0.1L×0.1 mol·L-1×2=0.02mol,100mL 0.4 mol·L-1的NaOH溶液中n(OH-)=0.1L×0.4 mol·L-1=0.04mol,两溶液混合后氢氧根离子过量,所得溶液中c(OH-)=![]() = 0.1mol/L,则c(H+)=
= 0.1mol/L,则c(H+)=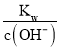 =10-11mol/L,则pH= -lgc(H+)=11,故答案为:11。
=10-11mol/L,则pH= -lgc(H+)=11,故答案为:11。
【题型】综合题
【结束】
24
【题目】已知25 ℃时,部分弱电解质的电离平衡常数数据如下表:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
(1)用离子方程式表示Na2CO3溶液呈碱性的原因:____________________。
(2)等物质的量浓度的A.CH3COONa B.NaCN C.Na2CO3 D.NaHCO3溶液的pH由大到小的顺序为____________________________________(填字母)。
(3)已知在25℃时, 将HCN溶液与NaOH溶液等体积等浓度混合后,此溶液中离子浓度由大到小的顺序是____________________________________。
(4)常温下,0.1mol·L-1的CH3COOH溶液加水稀释,下列表达式的数据变大的是______。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
(5)体积均为10 mL ,pH均为2的醋酸溶液与盐酸分别与足量Zn反应,反应刚开始时产生H2的速率:v(HCl)______v(CH3COOH)(填“=”、“>”或“<”下同),反应完全后,所得氢气的质量:m(H2)盐酸_______m(H2)醋酸。

