��Ŀ����
����Ŀ���ظ���أ�K2Cr2O7����Ƥ����ӡȾ��ѧ����Ƶȷ���Ӧ�ù㷺���ش��������⣺
��1���Ƽ�����Σ����ᰲȫ�����ڲⶨ�Ƿ����Ƶķ������ظ���ط�����Һ�ɳȺ�ɫ��Ϊ��ɫ��Cr3+��������Ѿ����ơ�д���ظ���ط��������Ƶ����ӷ���ʽ��___________________________��
��2���ø�����FeOCr2O3����Al2O3���ʣ�Ϊԭ���Ʊ��ظ���صĹ��գ�
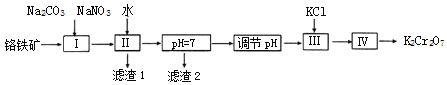
��֪��i. 2CrO42��+2H+ ![]() Cr2O72��+H2O��
Cr2O72��+H2O��
ii�����£�Ksp[Al��OH��3]��1.3��10��33��
iii���й����ʵ��ܽ��������ͼ��
��������������ͼ�еIJ���I����Ҫ��ӦΪ��2FeOCr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2��+7NaNO2������һ����Ӧ�Ļ�ѧ����ʽ��__________��
4Na2CrO4+Fe2O3+4CO2��+7NaNO2������һ����Ӧ�Ļ�ѧ����ʽ��__________��
������2�ijɷ���_____��д��ѧʽ�������£���Һ�У�c��Al3+����_____molL��1
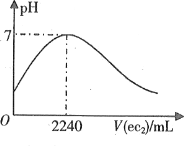
�۹�������ͼ�У�����������pH����������_________________________________��
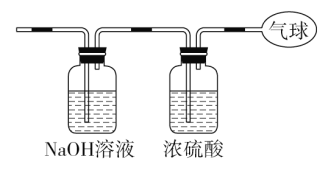
�ܲ�������KCl��Ŀ����________________________________________��ʵ�����У�����IV�õ��IJ��������оƾ��ơ��ձ���___________________��
���𰸡�2Cr2O72��+3C2H5OH+16H+��4Cr3++3CH3COOH+11H2O Al2O3+Na2CO3![]() 2NaAlO2+CO2�� Al��OH��3 1.3��10��12 CrO42��ת��ΪCr2O72�� ʹNa2Cr2O7ת��ΪK2Cr2O7 ©������������
2NaAlO2+CO2�� Al��OH��3 1.3��10��12 CrO42��ת��ΪCr2O72�� ʹNa2Cr2O7ת��ΪK2Cr2O7 ©������������
��������
��1���Ҵ����л�ԭ�ԣ�������Ϊ����ظ���ؾ��������ԣ���Ԫ�ش������۽���Ϊ�����ۣ����ݵ�ʧ��������ȣ������غ���ƽ����ʽ��
��2��������ͨ�����գ�2FeOCr2O3+4Na2CO3+7NaNO3![]() 4Na2CrO4+Fe2O3+4CO2��+7NaNO2��Al2O3+Na2CO3
4Na2CrO4+Fe2O3+4CO2��+7NaNO2��Al2O3+Na2CO3![]() 2NaAlO2+CO2���õ�Na2CrO4��Fe2O3��MgO��NaAlO2�Ļ����ϵ��Ȼ���ˮ�ܽ⣬���˷��룬�õ�����Fe2O3����Һ�к���Na2CrO4��NaAlO2���ٵ�����Һ��pH��ʹƫ��������ȫת��Ϊ�����������������˷��룬��Һ��������pHֵ��ʹ�� CrO42��ת��ΪCr2O72�� �������Ȼ���ʹNa2Cr2O7ת��ΪK2Cr2O7����������Ũ������ȴ�ᾧ�����˵ķ����õ�K2Cr2O7���壬�ݴ˽��з�����
2NaAlO2+CO2���õ�Na2CrO4��Fe2O3��MgO��NaAlO2�Ļ����ϵ��Ȼ���ˮ�ܽ⣬���˷��룬�õ�����Fe2O3����Һ�к���Na2CrO4��NaAlO2���ٵ�����Һ��pH��ʹƫ��������ȫת��Ϊ�����������������˷��룬��Һ��������pHֵ��ʹ�� CrO42��ת��ΪCr2O72�� �������Ȼ���ʹNa2Cr2O7ת��ΪK2Cr2O7����������Ũ������ȴ�ᾧ�����˵ķ����õ�K2Cr2O7���壬�ݴ˽��з�����
��1������������ԭ��Ӧ�л��ϼ�������ȣ������غ㣬д�����ӷ���ʽΪ2Cr2O72��+3C2H5OH+16H+��4Cr3++3CH3COOH+11H2O��
�𰸣�2Cr2O72��+3C2H5OH+16H+��4Cr3++3CH3COOH+11H2O��
��2����Al2O3��Ϊ���������Ҳ���Ժʹ����ڸ��������·�Ӧ����ƫ�����ƺͶ�����̼������ʽΪAl2O3+Na2CO3![]() 2NaAlO2+CO2����
2NaAlO2+CO2����
�𰸣�Al2O3+Na2CO3![]() 2NaAlO2+CO2����
2NaAlO2+CO2����
����Һ�к���Na2CrO4��NaAlO2��������Һ��pH=7��ʹƫ��������ȫת��Ϊ�����������������˷��룻����Ksp[Al��OH��3]��1.3��10��33=c��Al3+����c��OH-��3����c��Al3+��=![]() = 1.3��10��12��
= 1.3��10��12��
�𰸣�Al��OH��3 ��1.3��10��12��
������2CrO42��+2H+ ![]() Cr2O72��+H2O��֪������������pH����������ʹ CrO42��ת��ΪCr2O72����
Cr2O72��+H2O��֪������������pH����������ʹ CrO42��ת��ΪCr2O72����
�𰸣�CrO42��ת��ΪCr2O72����
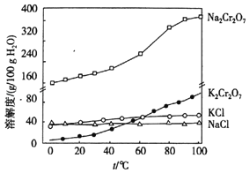
��������������KCl��Ŀ����ʹNa2Cr2O7ת��ΪK2Cr2O7����������Ũ������ȴ�ᾧ�����˵ķ����õ�K2Cr2O7���壬���ò��������оƾ��ơ��ձ���©������������
�𰸣�ʹNa2Cr2O7ת��ΪK2Cr2O7��©������������