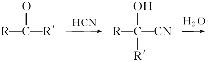
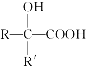
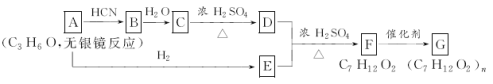
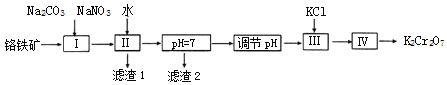
题目内容
【题目】下列说法不正确的是( )
A.室温下浓度均为0.1 mol/L的盐酸和氨水混合呈中性时,消耗盐酸的体积大于氨水
B.室温下向0.1 mol/L氨水中加入等浓度等体积的盐酸,溶液导电能力增强
C.室温下pH相等的CH3COOH溶液和盐酸中,c(OH-)相等
D.室温下pH=1的CH3COOH溶液和pH=13的NaOH溶液中,c(CH3COO-)=c(Na+)
【答案】A
【解析】
A. 氯化铵为强酸弱碱盐,其水溶液呈酸性,要使混合溶液呈中性,则氨水应该稍微过量,由于二者物质的量浓度相等,因此氨水体积要大于盐酸,A错误;
B. 溶液导电性与离子浓度成正比,一水合氨是弱电解质,氯化铵是强电解质,向0.1 mol/L氨水中加入等浓度等体积的盐酸,二者恰好反应产生NH4Cl,混合后溶液中离子浓度增大,因此溶液导电性增强,B正确;
C. 室温下pH相等的醋酸和盐酸溶液中c(H+)相等,温度不变离子积常数不变,溶液中c(OH-)=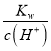 也相等,C正确;
也相等,C正确;
D. 室温下pH=1的醋酸溶液中c(H+)=0.1 mol/L,pH=13的NaOH溶液中c(OH-)=0.1 mol/L,各溶液中都存在电荷守恒,根据电荷守恒得c(H+)=c(CH3COO-)+c(OH-)、c(OH-)=c(Na+)+c(H+),根据室温下水的离子积等于常数,所以酸中c(OH-)等于碱中c(H+),所以存在c(CH3COO-)=c(Na+),D正确;
故合理选项是A。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】含MgCl2、AlCl3均为nmol的混合溶液,向其中滴NaOH溶液至过量。加入NaOH的物质的量与生成沉淀的物质的量的关系正确的是(离子(或物质)沉淀pH见表)
离子 | Mg2+ | Al3+ | 物质 | Al(OH)3 |
开始沉淀时的pH | 8.93 | 3.56 | 开始溶解时的pH | 8.04 |
完全沉淀时的pH | 10.92 | 4.89 | 完全溶解时的pH | 12.04 |
A. 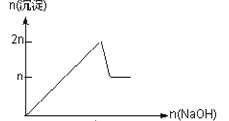
B. 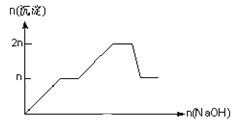
C. 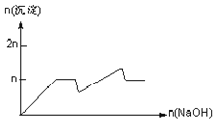
D. 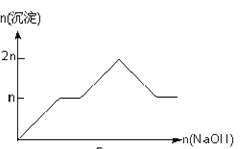
【题目】下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
a | |||||||||||||||||
b | c | d | e | ||||||||||||||
f | g | ||||||||||||||||
h | |||||||||||||||||
(1)请画出上述元素h的原子结构示意图_______;元素h位于元素周期表的第_____区。
(2)e、g两种元素的气态氢化物中更稳定的是_______(写化学式);
(3)b2a2分子的电子式是________ ,该分子中存在的σ键与π键的个数比为_______。
(4)c、d两种元素中第一电离能较大的是_________(写元素符号)。
(5)f和g两种元素形成的化合物是______(填“离子化合物”“共价化合物”)。a2d分子是_________分子(填极性分子或者非极性分子)。