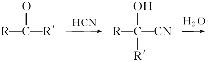
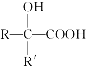
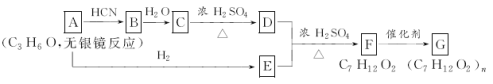
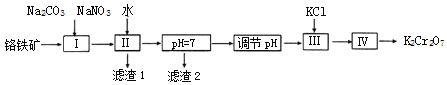
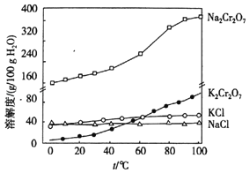
��Ŀ����
����Ŀ������14.4 g CO��CO2�Ļ�����壬�ڱ�״������ռ�����ԼΪ8.96 L���ش��������⣺
(1)�û�������ƽ��Ħ��������_________________________��
(2)���������̼ԭ�ӵĸ�����_________________________
(��NA��ʾ�����ӵ�������ֵ)��
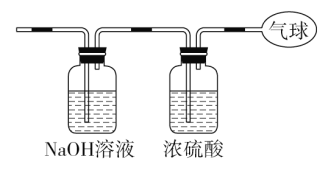
(3)�������������ͨ����ͼװ�ã�����ռ��������С�
���������ռ���������Ħ��������_______________________��
��������������ռ�������������Ϊ___________________��
���������ռ���������ĵ�������Ϊ_____________________
(��NA��ʾ�����ӵ�������ֵ)��
���𰸡�36 g��mol��1 0.4NA 28 g��mol��1 4.48 L 2.8NA
��������
(1)�����������Ϊ8.96 L���������ʵ���Ϊn��![]() =
=![]() ��0.4 mol����������ƽ��Ħ������Ϊ
��0.4 mol����������ƽ��Ħ������Ϊ![]() ��36 g��mol��1��
��36 g��mol��1��
(2)���������� CO�����ʵ���Ϊx mol��CO2�����ʵ���Ϊy mol������ݻ���������Ϊ14.4 g�ɵã�28x��44y��14.4������������������ʵ���Ϊ0.4 mol������x��y��0.4�������٢��ã�x��0.2 mol��y��0.2 mol������CO��CO2�о���1��̼ԭ�ӣ���0.2 mol CO��0.2 mol CO2�й���0.4 mol Cԭ�Ӽ�0.4NA����
(3)�������������ͨ����ͼװ�ã���CO2�ᱻNaOH��Һ���գ�ʣ��CO����Ũ�������������������ռ������Ǹ��﴿����CO���壻
���������ռ���������ΪCO����һ�����ʵ�Ħ����������ֵ�ϵ��ڸ����ʵ���Է������������ռ����������Ħ������Ϊ28 g��mol��1��
�������е�����ΪCO�������V��nVm��0.2 mol��22.4 L��mol��1��4.48 L��
��1��CO����14�����ӣ���(2)�����CO�����ʵ���Ϊ0.2 mol������ӵ����ʵ���Ϊ0.2 mol��14��2.8 mol����������Ϊ2.8NA����

 ��������һ���þ�ϵ�д�
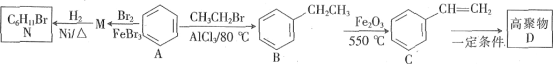
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ����ͼ��Ԫ�����ڱ���һ���֣�A��B��C��D��E��X�����ڱ�����Ԫ����ɵij������ʻ��
�� | |||||||||||||||||
�� | �� | �� | |||||||||||||||
�� | �� | �� | |||||||||||||||
Fe | As | ||||||||||||||||
I��Ԫ�����ڱ��������о��������ʵ���Ҫ���ߡ�Y�ɢڢޢ�����Ԫ����ɣ�����ˮ��Һ�������г�������������As����Y��ˮ��Һ��Ӧ��������As����ۺ����ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪ_______��������1mol��ԭ��ʱ��ת�Ƶĵ��Ӹ���Ϊ_______��
��A��B��C��D��E��X��������ͼת����ϵ������������ͷ�Ӧ������ȥ����

��1������EΪ�������ôA��ˮ��Ӧ�Ļ�ѧ����ʽΪ_______��
����X�Ǽ�������Һ��C��������22������ʱ����ôC�ĵ���ʽΪ_______��
����ʾ
����XΪ��������ʱ����ôX��B��ϡ��Һ��Ӧ����C�����ӷ�Ӧ����ʽΪ_______��
��2������EΪ�������壬DΪ��ɫ������B���еĻ�ѧ������Ϊ_______��C��X��Ӧ�����ӷ���ʽΪ_______��
��3���ٺ͢��γɵĻ�������һ�ֿ�ȼ��Һ�壬��ȼ�ղ���֮һ�Ǵ����е�Ҫ���ɷ֣�1.6�˸���������������ȫȼ�շų�����31.2kJ��д���Ȼ�ѧ����ʽ_______��
��4����ӡˢ��·���Ϻ���ͭ�������Ļ��շ����ǽ�������ʹͭת��Ϊ����ͭ�����������ܽ⡣�ָ��âٺ͢���ɵĻ������ϡ������ݷ�ӡˢ��·��ȴﵽ����Ŀ�ģ��ֱ����˻�������д����Ӧ�����ӷ���ʽ_______��
��5��Ԫ�آڵĵ�����һ�������£�����ٵĵ��ʻ�������һ�ֻ�����۵�Ϊ800�档�û���������ˮ��Ӧ�����������轫1mol�û������1mol���γɵĵ��ʻ�ϼ���������ˮ����ַ�Ӧ���������������ǣ���״���£�_______��
����Ŀ����MgCl2��AlCl3��Ϊnmol�Ļ����Һ�������е�NaOH��Һ������������NaOH�����ʵ��������ɳ��������ʵ����Ĺ�ϵ��ȷ���ǣ����ӣ������ʣ�����pH������
���� | Mg2+ | Al3+ | ���� | Al(OH)3 |
��ʼ����ʱ��pH | 8.93 | 3.56 | ��ʼ�ܽ�ʱ��pH | 8.04 |
��ȫ����ʱ��pH | 10.92 | 4.89 | ��ȫ�ܽ�ʱ��pH | 12.04 |
A. 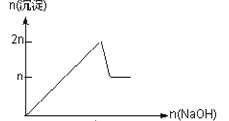
B. 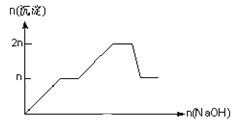
C. 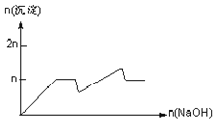
D. 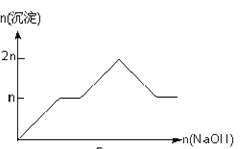
����Ŀ���±�ΪԪ�����ڱ���һ���֣�a��b��c��Ϊ����Ԫ�ء��ش��������⣺
a | |||||||||||||||||
b | c | d | e | ||||||||||||||
f | g | ||||||||||||||||
h | |||||||||||||||||
(1)�뻭������Ԫ��h��ԭ�ӽṹʾ��ͼ_______��Ԫ��hλ��Ԫ�����ڱ��ĵ�_____����
(2)e��g����Ԫ�ص���̬�⻯���и��ȶ�����_______��д��ѧʽ����
(3)b2a2���ӵĵ���ʽ��________ ���÷����д��ڵ������������ĸ�����Ϊ_______��
(4)c��d����Ԫ���е�һ�����ܽϴ����_________��дԪ�ط��ţ���
(5)f��g����Ԫ���γɵĻ�������______���������ӻ������������ۻ�����������a2d������_________���ӣ���Է��ӻ��߷Ǽ��Է��ӣ���