题目内容
【题目】【选修2 :化学与技术】
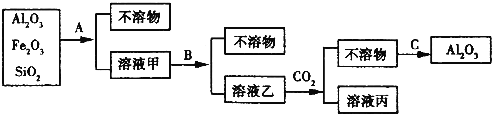
某工厂的镀铜废水中含有CN-和Cr2O72一离子,需要处理达标后才能排放。该厂拟用下列流程进行废水处理,回答下列问题:
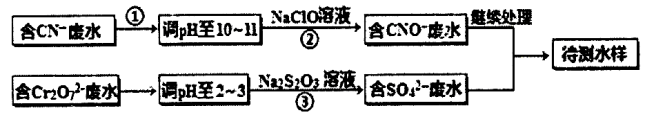
(1)流程中可用pH 试纸测定溶液的pH,pH试纸的使用方法是_______;
(2)步骤②中反应无气体放出,该反应的离子方程式为____;
(3)步骤③中,每处理1.0molCr2O7—时转移电子数为6NA,该反应的离子方程式为_____;
(4)取少量待测水样于试管中,加入NaOH 溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,产生该现象对应的离子方程式为_________。
(5)含氰化物的废水必须经检测达标后(排放标准为CN—的含量<0.5mg/L)才能排放。现取该法处理 后的废水100.0mL,用“试银灵”为指示剂、1.0×10-4mol/L的AgNO3标准溶液滴定,终点时溶液由黄色变为橙红色,消耗标准液的体积为5.00mL,反应的离子方程式为Ag + 2CN—=[Ag(CN)2]一,该水样中CN-的含量为________mg/L(不考虑Cr等元素的干扰)。该厂处理后的废水能否合法排放________。
【答案】(1)用镊子夹取一小块试纸放在洁净的玻璃片或表面皿上,用玻璃棒蘸取待测溶液点在试纸的中央,变色后与标准比色卡对照,即可确定溶液的pH (其他合理答案亦可)( 2分)
(2)CN-+ClO-=CNO-+Cl-(3分)
(3)3S2O32-+4Cr2O72-+26H+=6SO42-+Cr3++13H2O(3分)
(4)Cu2++2OH=Cu(OH)2↓ Cu(OH)2(S)+S2- (aq)=CuS(s)+2OH-(aq)(各2分)
(5)0.26(2分)能(1分)
【解析】
试题分析:(1)用PH试纸测定溶液PH的方法:用镊子夹取一小块试纸放在洁净的玻璃片或表面皿上,用玻璃棒蘸取待测溶液点在试纸的中央,变色后与标准比色卡对照,即可确定溶液的pH 。(2)CN- 具有很强的还原性,ClO- 具有很强的氧化性,故该氧化还原反应的离子方程式为CN-+ClO-=CNO-+Cl-。(3)3S2O32-+4Cr2O72-+26H+=6SO42-+Cr3++13H2O(4)该待测水样为镀铜废水,而Cu(OH)2是高中阶段需要掌握的唯一一种蓝色沉淀,且KSP(CuS)<KSP(Cu(OH)2),所以产生现象的对应的离子方程式是:Cu2++2OH=Cu(OH)2↓ Cu(OH)2(S)+S2- (aq)=CuS(s)+2OH-(aq)。(5)nAg+=5×10-7mol,所以nCN-=1×10-6,mol=2.6×10-2mg,故C(CN-)=0.26mg/L,达到标准所以可以排放。

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案