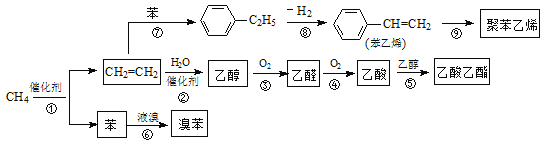
题目内容
【题目】为了探究化学反应中的能量变化,某同学设计了如下两个实验。

(1)图Ⅰ中发生反应的化学方程式为 ,实验中温度计指示的温度变化及其原因是 。
(2)图Ⅱ实验的实验现象如下表,请完成相应实验现象的解释。
实验现象 | 解释原因 |
Cu片上产生了大量气泡 | |
温度计指示的温度无明显变化 |
(3)若将图中的Cu片替换为Fe片,则Fe片上的电极反应式为 。
【答案】(1)Zn+H2SO4=ZnSO4+H2↑;升高;锌与稀硫酸反应是放热反应
(2)Zn、Cu构成原电池,H+在Cu片上得电子产生氢气;反应中的化学能主要转化成了电能。
(3)2H++2e-=H2↑
【解析】
试题分析:(1)图Ⅰ中发生反应为活泼金属与酸的置换反应,该的化学方程式为:Zn+H2SO4=ZnSO4+H2↑;实验中温度计指示的温度升高,原因是锌与稀硫酸反应是放热反应。
故答案为:Zn+H2SO4=ZnSO4+H2↑;升高;锌与稀硫酸反应是放热反应。
(2)图Ⅱ所示为铜锌原电池实验装置,活泼金属锌做负极,发生氧化反应逐渐溶解;铜为正极,发生还原反应H+在Cu片上得电子产生氢气;由于该反应中化学能主要转化为电能,所以溶液温度无明显变化。
故答案为:Zn、Cu构成原电池,H+在Cu片上得电子产生氢气;反应中的化学能主要转化成了电能;
(3)若将图中的Cu片替换为Fe片,则铁为正极,Fe片上的电极反应式为:2H++2e-=H2↑。
故答案为:2H++2e-=H2↑。

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目