题目内容
【题目】阿伏加德罗常数的值为NA,下列说法中正确的是( )
A. 5NH4NO3 ![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2,转移的电子数目为3.75NA
B. 常温常压下,ag某气体含分子数为b,则cg该气体的体积为![]()
C. 2mol/L的CaCl2溶液中Cl-的数目为4NA
D. 46g NO2和N2O4的混合气体中含有的氧原子个数为3NA
【答案】A
【解析】
A、反应中铵根离子中的氮从-3价升高到氮气中的+5价,每生成4mol氮气转移15mol电子,所以当有28g氮气生成时,转移电子为3.75mol,转移的电子数目为3.75NA,故A正确;
B、常温常压下,气体的摩尔体积不能用22.4L/mol故B错误;
C、2mol/L的CaCl2溶液中Cl-的浓度为2mol/L,题干中没有给出溶液体积,所以不能确定氯离子数目,故C错误;
D、NO2和N2O4的最简式都是NO2,所以只要把混合气体当作只含NO2看就可以了。46gNO2是1mol,一个NO2分子含2个氧原子,所以合气体中含有氧原子个数为2NA,故D错误;
综上所述,本题应选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuCl2·3H2O及CaCO3的步骤如下:
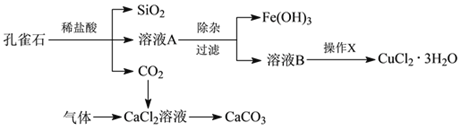
为解决有关问题,兴趣小组同学查得有关物质沉淀的pH数据如下:
物质 | pH (开始沉淀) | pH(完全沉淀) |
Fe(OH)3 | 1.9 | 3.2 |
Fe(OH)2 | 7.0 | 9.0 |
Cu(OH)2 | 4.7 | 6.7 |
(1)在除杂过程时为了除去Fe2+,常加入绿色氧化剂,使Fe2+氧化为Fe3+,此过程涉及的离子方程式为________。
(2)然后再加入适当物质调节溶液的pH至_________ (填写范围),使Fe3+转化为Fe(OH)3,可以达到除去Fe3+,调整溶液pH不可选用下列中的________。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(3)检验Fe(OH)3是否沉淀完全的实验方案是________________________。
(4)操作X包括________、________、过滤和洗涤等。CuCl2·3H2O加热灼烧的最终产物的化学式是 ______________。
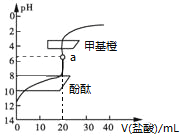
(5)某种胃药片的治酸剂为CaCO3,该药片中CaCO3质量分数的测定步骤如下:
a.配制0.1mol·L-1的HCl溶液和0.1mol·L-1的NaOH溶液各250mL。
b.取0.6g磨碎后的胃药于锥形瓶中。
c.向锥形瓶内加入25.00mL 0.1 mol·L-1的HCl溶液。
d.以酚酞为指示剂,用0.1mol·L-1的NaOH溶液滴定,至达到滴定终点。
e.重复bcd三步的操作2次。
①读数时,若滴定前平视,滴定后仰视,则所测CaCO3的质量分数将________(选填“偏大”、“偏小”或“无影响”)。
②若滴定中NaOH溶液的平均用量为15.00mL,则胃药中碳酸钙的质量分数为_______。