题目内容
5.(1)用双线桥标出下列反应中电子转移的方向和数目,并根据要求填空Fe2O3+3CO═2Fe+3CO2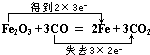 该反应中,氧化剂是Fe2O3,被还原的元素是Fe,还原产物是Fe,每消耗1molCO时,转移的电子的物质的量为2mol.
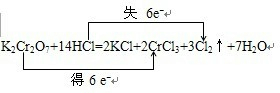
该反应中,氧化剂是Fe2O3,被还原的元素是Fe,还原产物是Fe,每消耗1molCO时,转移的电子的物质的量为2mol.(2)用双线桥标出下列反应中电子转移的方向和数目.KClO3+6HCl═+KCl+3Cl2↑+3H2O
 .
.
分析 (1)Fe2O3+3CO═2Fe+3CO2中,Fe元素的化合价降低,C元素的化合价升高,该反应中转移6e-;
(2)反应中KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,Cl元素化合价分别由+5价、-1价变化为0价,当有3mol Cl2生成时,转移5mol电子,以此解答该题.
解答 解:(1)Fe元素的化合价由+3降低为0,C元素的化合价由+2升高为+4价,则Fe2O3为氧化剂,Fe元素被还原,对应Fe为还原产物,该反应中3molCO参加反应,转移6mol电子,则双线桥表示该反应电子转移的方向和数目为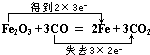 ,每消耗1molCO时,转移的电子的物质的量为2mol,
,每消耗1molCO时,转移的电子的物质的量为2mol,
故答案为: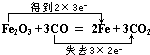 ;Fe2O3;Fe;Fe;2;
;Fe2O3;Fe;Fe;2;
(2)该反应中,氯酸钾中氯元素的化合价由+5价变为0价,所以氯酸钾是氧化剂,HCl中Cl元素化合价由-1价升高到0价,被氧化,既是氧化产物也是还原产物,得电子与失电子个数相等,比值为1:1,氧化产物和还原产物的质量之比是5:1,只有Cl元素化合价发生变化,当有3mol Cl2生成时,转移5mol电子,则电子转移的方向和数目为 ,故答案为:
,故答案为: .
.
点评 本题考查氧化还原反应,为高频考点,把握电子守恒、原子守恒及反应中元素化合价变化为解答的关键,侧重基本概念及转移电子的考查,题目难度不大.

练习册系列答案
相关题目
15.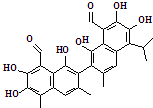 棉籽中可以提取出一种叫做棉酚的物质,具有抗癌作用,其市场价格相当于黄金价格的60倍.棉酚的结构如图所示,下列关于棉酚的说法不正确的是( )
棉籽中可以提取出一种叫做棉酚的物质,具有抗癌作用,其市场价格相当于黄金价格的60倍.棉酚的结构如图所示,下列关于棉酚的说法不正确的是( )
 棉籽中可以提取出一种叫做棉酚的物质,具有抗癌作用,其市场价格相当于黄金价格的60倍.棉酚的结构如图所示,下列关于棉酚的说法不正确的是( )
棉籽中可以提取出一种叫做棉酚的物质,具有抗癌作用,其市场价格相当于黄金价格的60倍.棉酚的结构如图所示,下列关于棉酚的说法不正确的是( )| A. | 棉酚放置在空气中容易变质 | |
| B. | 用核磁共振氢谱可以证明棉酚分子中有9种氢原子 | |
| C. | 棉酚完全燃烧产生的CO2的物质的量是H2O的2倍 | |
| D. | 棉酚能与NaOH溶液、溴水发生反应 |
16.25℃时,pH均为11的Na2CO3溶液和NaOH溶液,则由水电离的OH-离子浓度之比为( )
| A. | 1010:1 | B. | 5×109:1 | C. | 108:1 | D. | 1:1 |
20.在无色透明的酸性溶液中,能大量共存的离子组是( )
| A. | Mg2+、Ag+、NO3-、Cl- | B. | Cu2+、Na+、SO42-、Cl- | ||
| C. | Ba2+、K+、NO3-、Cl- | D. | Zn2+、Na+、OH-、SO42- |
10.下列说法错误的是( )
| A. | 从1L1mol/L的氯化钠溶液中取出10ml,其浓度仍是1mol/L | |
| B. | 制成0.5L10mol/L的盐酸,需要氯化氢气体112L(标准状况) | |
| C. | 0.5 L 2mol/L的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023 | |
| D. | 10g 98%硫酸(密度为1.84g/cm3)与10mL18.4mol/L硫酸的浓度是不同的 |
18.下列说法中正确的一组是( )
| A. | H2和D2互为同位素 | B. | 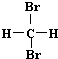 和 和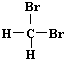 互为同分异构体 互为同分异构体 | ||
| C. | H、D、T互称为同素异形体 | D. | 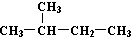 和 和 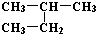 是同一种物质 是同一种物质 |