题目内容
【题目】聚合硫酸铁铝、聚合氯化铝是高效水处理剂。以废铁屑、废铝质易拉罐及硫酸为原料,制备聚合硫酸铁铝的工艺流程如下:
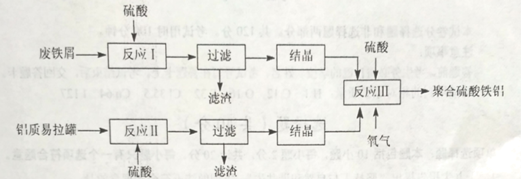
(1) 为提高反应I、II金属元素的浸出率,可以采取的措施有___。
(2) 反应III中FeSO4转化为Fe2(SO4)3的化学方程式为_____。
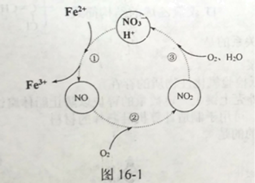
(3) 反应III的温度应控制在50℃~70℃为宜,原因是_____。反应II过程中往往加入少量硝酸铝,其作用如图16-1所示,转化①的离子方程式为___。
(4) 写出Fe2(SO4)3 水解生成Fe2(OH)n(SO4)3-n/2 的离子方程式:_____。
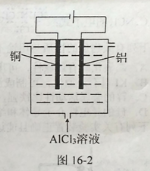
(5) 利用图16-2所示电解装置可制备净水剂聚合氯化铝。实际生产中,阳极附近因为副反应可能产生的气体有____________。
【答案】适当提高硫酸浓度;适当提高反应温度等 4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O 温度过低,反应速率太慢;温度过高,金属离子水解趋势增强,易形成沉淀,影响产品的质量 3Fe2++4H++NO3-=3Fe3++NO↑+2H2O 2Fe3++(3-n/2)SO42-+nH2O![]() Fe2(OH)n(SO4)3-n/2+nH+ Cl2、O2
Fe2(OH)n(SO4)3-n/2+nH+ Cl2、O2
【解析】
⑴从影响化学反应速率的因素来考虑;
⑵根据得失电子守恒、质量守恒来书写;
⑶从温度对反应速率和盐类水解的影响来分析,由图中元素化合价的变化来确定反应物、生成物,根据有关守恒写出离子方程式;
⑷根据盐类水解的实质是盐和水反应生成酸和碱来书写;
⑸阳极发生的是氧化反应,从阳极附近溶液中的离子的性质来考虑,根据以上分析解答。
⑴为提高反应I、II金属元素的浸出率,可增大反应物浓度、升高温度等;
⑵反应III中通入氧气,在酸性条件下可将FeSO4氧化为Fe2(SO4)3,化学方程式为4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O;
⑶温度过低,反应速率较小,如温度过高,可促进金属离子的水解,易产生沉淀,影响产品的质量;由图可知,转化①为酸性条件下,硝酸根离子氧化亚铁离子,根据得失电子守恒、电荷守恒、原子守恒,该反应的离子方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
⑷ Fe2(SO4)3 水解生成Fe2(OH)n(SO4)3-n/2,水解后溶液显酸性,反应的离子方程式为:2Fe3++(3-![]() )SO42-+nH2OFe2(OH)n(SO4)3-n/2+nH+;
)SO42-+nH2OFe2(OH)n(SO4)3-n/2+nH+;
⑸阳极发生氧化反应,阳极材料Al、溶液里的Cl-、OH-都可被氧化,副反应可能产生的气体有Cl2、O2。

【题目】某研究性学习小组的同学在学习了二氧化碳与过氧化钠的反应后,对过氧化钠与二氧化硫的反应进行实验探究。
(1)提出假设:
假设1. 固体产物是Na2SO3
假设2. _________________________
假设3. 固体产物是Na2SO3和Na2SO4的混合物。
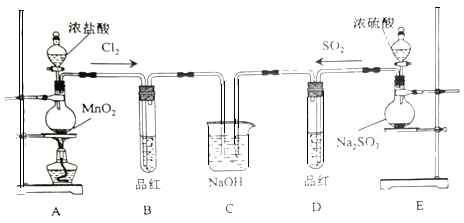
(2)实验验证:用如图所示装置对上述假设进行实验。
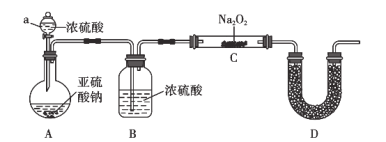
(1)仪器a的名称为__________,装置A中发生反应的化学方程式为:________________________。
(2)装置B的作用为________________________,装置D中试剂的名称为________。
(3)装置C中固体完全反应后,得到白色固体,进行如下实验。
实验操作 | 预期现象与结论 |
步骤1.取少量白色固体于试管中,加入足量的稀盐酸,将生成的气体通入品红溶液。 | 若_____________,说明白色固体中含有Na2SO3。 |
步骤2.在步骤1反应后的溶液中加入________ | 若_____________,说明白色固体中含有Na2SO4。 |
通过实验探究发现上述两个实验现象均有,则说明假设3正确。