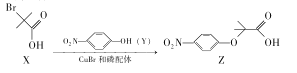
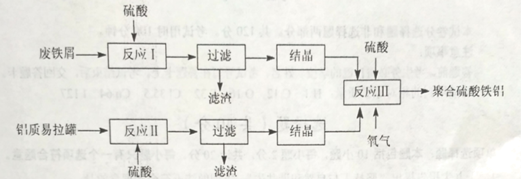
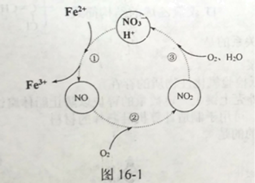
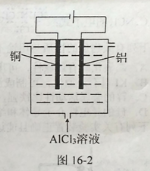
��Ŀ����
����Ŀ����������������Ҫ�ɷ�ΪFe2O3��������SiO2��FeO�������Ʊ��ߴ��ȵ����������Ʊ�������ͼ��
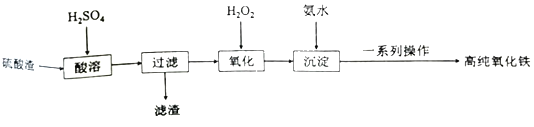
��1����������Ҫ�ɷ���___��
��2����������ʱ������Ӧ�����ӷ���ʽΪ___��
��3����������Ƿ���ȫ�ķ���Ϊ___��
��4��һϵ�в������������ˡ����ӡ����___��
��5���ø��·ֽ�FeSO4Ҳ�����Ʊ��ϴ���Fe2O3��д����Ӧ�Ļ�ѧ����ʽ___��
��6����������������28%������ߴ�������64�֣��������������������ٶ֣�___��д��������̣�
���𰸡�SiO2 2Fe2++H2O2+2H+��2Fe3++2H2O ���ã�ȡ���ɳ�������ϲ���Һ���������軯����Һ������Ѫ��ɫ�������������ȫ ���������� FeSO4![]() Fe2O3+SO2��+SO3�� 160t
Fe2O3+SO2��+SO3�� 160t
��������
������(��Ҫ��![]() ������Ϊ
������Ϊ![]() ��
��![]() ��)�������ܽ⣬����������ת��Ϊ���������ӣ��������費�ܣ����ˣ��õ����ж�����������������Һ�Ͷ��������������ټ�˫��ˮ��������������Ϊ
��)�������ܽ⣬����������ת��Ϊ���������ӣ��������費�ܣ����ˣ��õ����ж�����������������Һ�Ͷ��������������ټ�˫��ˮ��������������Ϊ![]() �����백ˮ���õ����������ij������ٹ��ˡ�ϴ�ӡ�������յõ���������������
�����백ˮ���õ����������ij������ٹ��ˡ�ϴ�ӡ�������յõ���������������
��1�����ݷ������
��2��˫��ˮ��������������Ϊ![]() ��
��
��3������Ϊ������������û�г�����ȫ���������������Լ�������Ƿ���ȫ�ķ����ǣ����ã�ȡ���ɳ�������ϲ���Һ���������軯����Һ������Ѫ��ɫ�������������ȫ��
��5�����������ڸ��������£�������ԭ��Ӧ�õ��������������������������
��6��������Ԫ���غ������
��1�����ݷ�����������ҪΪSiO2���ʴ�Ϊ��SiO2��
��2��˫��ˮ��������������ΪFe3+�����ӷ���ʽΪ2Fe2++H2O2+2H+��2Fe3++2H2O���ʴ�Ϊ��2Fe2++H2O2+2H+��2Fe3++2H2O��
��3������Ϊ������������û�г�����ȫ�����������������Լ�������Ƿ���ȫ�ķ����ǣ����ã�ȡ���ɳ�������ϲ���Һ���������軯����Һ������Ѫ��ɫ�������������ȫ���ʴ�Ϊ�����ã�ȡ���ɳ�������ϲ���Һ���������軯����Һ������Ѫ��ɫ�������������ȫ��
��4��Ҫ����������ת��������������Ҫ���������أ��ʴ�Ϊ�����������أ�
��5�����������ڸ��������£�������ԭ��Ӧ�õ����������������������������ʽΪ��FeSO4![]() Fe2O3+SO2��+SO3�����ʴ�Ϊ��FeSO4
Fe2O3+SO2��+SO3�����ʴ�Ϊ��FeSO4![]() Fe2O3+SO2��+SO3����
Fe2O3+SO2��+SO3����
��6��������Ԫ���غ㣬����Ҫ��������Ϊx�֣�����������Ϊ28%x�֣�����������ȫ����Դ�ڴˣ�64������������������Ϊ![]() ��64t��44.8t��������ʽ��28%x��44.8t�����x��160t��
��64t��44.8t��������ʽ��28%x��44.8t�����x��160t��
������Ҫ��������Ϊx�֣�����������Ϊ28%x�֣�64������������������Ϊ![]() ��64t��44.8t��������ʽ��28%x��44.8t�����x��160t��
��64t��44.8t��������ʽ��28%x��44.8t�����x��160t��