题目内容
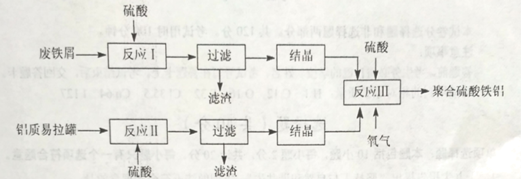
【题目】某化学实验小组为探究SO2、Cl2的性质,并比较SO2和氯水的漂白性,设计了如下的实验。
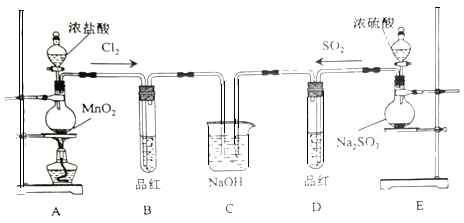
(1)图中盛放浓盐酸仪器的名称为___,装置A中发生反应的化学方程式___。
(2)反应一段时间后,B、D中品红褪色。反应结束后,分别加热B、D中的试管,可观察到的现象为:B___、D___。
(3)C装置的作用是吸收尾气,写出SO2与足量NaOH溶液反应的离子方程式:___。
(4)有同学将SO2和Cl2按1:1同时通入到品红溶液中,发现褪色效果并不明显。可能的原因是___(用化学方程式表示),设计实验证明上述原因___。
【答案】分液漏斗 MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑ 无明显现象 溶液由无色变为红色 Cl2+2OH﹣═Cl﹣+ClO﹣+H2O SO2+Cl2+2H2O=H2SO4+2HCl 取少量反应后的溶液少许加入试管中,加入氯化钡溶液生成白色沉淀证明生成了硫酸根离子,说明二氧化硫被氯气氧化
MnCl2+2H2O+Cl2↑ 无明显现象 溶液由无色变为红色 Cl2+2OH﹣═Cl﹣+ClO﹣+H2O SO2+Cl2+2H2O=H2SO4+2HCl 取少量反应后的溶液少许加入试管中,加入氯化钡溶液生成白色沉淀证明生成了硫酸根离子,说明二氧化硫被氯气氧化
【解析】
A用浓盐酸和 二氧化锰在加热条件下制备氯气,B用于检验气体的漂白性,C用于吸收尾气。E用于制备SO2,实验室用亚硫酸钠固体与硫酸反应制取![]() 气体,该反应为
气体,该反应为![]() ,D用于检验二氧化硫的生成,
,D用于检验二氧化硫的生成,
(1)图中盛放浓盐酸仪器为分液漏斗,![]() 和浓盐酸在加热的条件下制备氯气;
和浓盐酸在加热的条件下制备氯气;
(2)氯气和二氧化硫都能使品红溶液褪色,但是二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性;
(3)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(4)![]() 和
和![]() 按1:1通入,
按1:1通入,![]() 和
和![]() 恰 好反应,二者反应生成
恰 好反应,二者反应生成![]() 和
和![]() ,生成 物都无漂白性,取少量反应后的溶液少许加入试管中,加入氯化钡溶液生成白色沉淀证明生成了硫酸根离子。
,生成 物都无漂白性,取少量反应后的溶液少许加入试管中,加入氯化钡溶液生成白色沉淀证明生成了硫酸根离子。
(1)图中盛放浓盐酸仪器为分液漏斗,MnO2和浓盐酸在加热的条件下制备氯气,反应的化学方程式:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑,故答案为:分液漏斗;MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑,故答案为:分液漏斗;MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑;
MnCl2+2H2O+Cl2↑;
(2)氯气和二氧化硫都能使品红溶液褪色,但是二氧化硫漂白后的物质具有不稳定性,加热时又能变为红色,而氯气的漂白具有不可逆性,所以再给B、D两个试管分别加热,两个试管中的现象分别为B:无明显现象,D:溶液由无色变为红色,故答案为:无明显现象;溶液由无色变为红色;
(3)氯气与NaOH反应生成NaCl、NaClO和水,氯气、水在离子反应中保留化学式,该离子反应方程式:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O,故答案为:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O;
(4)SO2和Cl2按1:1通入,SO2和Cl2恰好反应,二者反应生成H2SO4和HCl,生成物都无漂白性,方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,生成物都无漂白性,设计实验证明上述原因是:取少量反应后的溶液少许加入试管中,加入氯化钡溶液生成白色沉淀证明生成了硫酸根离子,说明二氧化硫被氯气氧化,故答案为:SO2+Cl2+2H2O=H2SO4+2HCl;取少量反应后的溶液少许加入试管中,加入氯化钡溶液生成白色沉淀证明生成了硫酸根离子,说明二氧化硫被氯气氧化。

 学练快车道快乐假期寒假作业系列答案
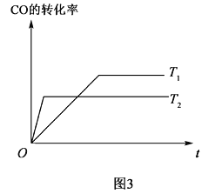
学练快车道快乐假期寒假作业系列答案【题目】在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:回答下列问题:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:回答下列问题:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=___。
(2)该反应为___反应(选填吸热、放热)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为___℃。此温度下加入2molCO2(g)和2molH2(g),充分反应,达到平衡时,H2的转化率为___。
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为:CO2(g)为2 mol/L,H2(g)为2mol/L,CO(g)为1mol/L,H2O(g)为3mol/L,则正、逆反应速率的关系为v(正)___v(逆)(填<、>、或=)