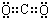题目内容
4. 为治理环境,减少雾霾,工业上通常用下列方法治理CO2和硫、氮氧化物的污染.
为治理环境,减少雾霾,工业上通常用下列方法治理CO2和硫、氮氧化物的污染.(1)用稀土等催化剂能将汽车尾气中的CO、NOx、碳氢化合物转化成无毒物质,从而减少汽车尾气污染.已知:
①N2(g)+O2(g)=2NO(g)△H1
②2C(s)+O2(g)=2CO(g)△H2
③C(s)+O2(g)=CO2(g)△H3
则2NO(g)+2CO(g)=N2(g)+2CO2(g)的反应热△H=2△H3-△H2-△H1(用△H1、△H2、△H3表示)
(2)用NH3还原NOx生成N2和H2O.现有NO、NO2的混合气3L,可用同温同压下3.5L的NH3恰好使其完全转化为N2,则原混合气体中NO和NO2的物质的量之比为1:3
(3)电化学降解治理水中硝酸盐的污染.在酸性条件下,电解NO3-的原理如右图所示,A为电源的正极,阴极电极反应式为2NO3-+12H++10e-=N2↑+6H2O.
分析 (1)已知:①N2(g)+O2(g)=2NO(g)△H1
②2C(s)+O2(g)=2CO(g)△H2
③C(s)+O2(g)=CO2(g)△H3
根据盖斯定律,③×2-②-①可得:2NO(g)+2CO(g)=N2(g)+2CO2(g),反应热也进行相应的计算;
(2)相同条件下,气体体积之比等于其物质的量之比,假设NO、NO2的混合气体为3mol,氨气为3.5mol,由于反应生成N2和H2O,根据H原子守恒计算H2O的物质的量,设NO、NO2的物质的量分别为xmol、ymol,由二者物质的量之和及氧原子守恒列方程计算解答;
(3)由图可知,硝酸根离子发生还有反应生成氮气,则Ag-Pt电极为阴极,Pt电极为阳极.
解答 解:(1)已知:①N2(g)+O2(g)=2NO(g)△H1
②2C(s)+O2(g)=2CO(g)△H2
③C(s)+O2(g)=CO2(g)△H3
根据盖斯定律,③×2-②-①可得:2NO(g)+2CO(g)=N2(g)+2CO2(g),所以△H2△H3-△H2-△H1,
故答案为:2△H3-△H2-△H1;
(2)相同条件下,气体体积之比等于其物质的量之比,假设NO、NO2的混合气体为3mol,氨气为3.5mol,由于反应生成N2和H2O,根据H原子守恒,则生成H2O的物质的量$\frac{3.5mol×3}{2}$=5.25mol,设NO、NO2的物质的量分别为xmol、ymol,由二者物质的量之和及氧原子守恒可得则:$\left\{\begin{array}{l}{x+y=3}\\{x+2y=5.25}\end{array}\right.$,解得x=0.75、y=2.25,故NO、NO2的物质的量之比为0.75mol:2.25mol=1:3,
故答案为:1:3;
(3)由图可知,硝酸根离子发生还有反应生成氮气,则Ag-Pt电极为阴极,Pt电极为阳极,则A为电池的正极,阴极上硝酸根获得电子,与通过质子交换膜的氢离子作用生成氮气与水,阴极电极反应式为:2NO3-+12H++10e-=N2↑+6H2O,
故答案为:正;2NO3-+12H++10e-=N2↑+6H2O.
点评 本题考查氧化还原反应计算、热化学方程式书写、电解池原理,需要学生具备扎实的基础,较好的考查学生运用知识分析解决问题的能力、对信息处理能力,(2)中旨在考查氧化还原反应计算,注意方法的灵活应用,难度中等.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案甲组:①甘氨酸 ②苯酚 ③醋酸 ④牛油 ⑤甲酸甲酯.
乙组:⑥甲醛 ⑦溴水 ⑧苛性钠溶液 ⑨金属钠 (10)氯化铁溶液.
甲组有一种物质与乙组中的五种物质均能反应;乙组有一种物质与甲组中的五种物质均能反应,则这两种物质分别是( )
| A. | ①⑦ | B. | ①⑧ | C. | ②⑧ | D. | ⑤⑨ |
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A. | 此反应为放热反应 | |
| B. | 此反应只有达到平衡时,密闭容器中的压强才不会变化 | |
| C. | 此反应达到1 000℃时的反应速率比700℃时大 | |
| D. | 该反应的化学平衡常数越大,反应物的转化率越低 |
| A. | 量筒 | B. | 酒精灯 | C. | 温度计 | D. | 环形玻璃搅拌棒 |

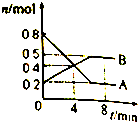 某温度时.在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,
某温度时.在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示,