题目内容
【题目】绿矾FeSO47H2O广泛用于医药和工业领域。以下是FeSO47H2O的实验室制备流程图。根据题意完成下列填空:

(1)碳酸钠溶液能除去酯类油污,是因为_________________________(用离子方程式表示),反应Ⅰ需要加热数分钟,其原因是______________________________。
(2)废铁屑中含氧化铁,反应II的离子方程式____________________,判断反应II完成的现象是: ______________________________________。
【答案】CO32-+H2O ![]() HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O![]() H2CO3+OH- 升温,促进水解,溶液碱性增强,使反应充分进行 Fe2O3+6H+=2Fe3++3H2O、2Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑ 铁屑不再溶解,表面无气泡产生
H2CO3+OH- 升温,促进水解,溶液碱性增强,使反应充分进行 Fe2O3+6H+=2Fe3++3H2O、2Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑ 铁屑不再溶解,表面无气泡产生
【解析】
(1)碳酸钠是强碱弱酸盐,弱酸根离子发生水解反应,结合油脂中的水解反应原理分析;盐的水解反应是吸热反应,根据化学平衡移动原理分析温度对盐水解的影响;
(2)废铁屑中含有Fe、Fe2O3,当向其中加入稀硫酸时,Fe2O3与硫酸反应产生硫酸铁和水;铁与硫酸反应产生硫酸亚铁和水,铁与硫酸铁反应产生硫酸亚铁,据此书写反应方程式;Fe与酸反应会放出气体,若反应完全,最终不会发生固体溶解及产生气泡现象。
(1)碳酸钠是强碱弱酸盐,在溶液中盐电离产生的弱酸根离子CO32-发生水解反应,CO32-+H2O ![]() HCO3-+OH-,消耗水电离产生的H+,使溶液中c(OH-)>c(H+),水解产生的HCO3-会进一步发生水解反应:HCO3-+H2O
HCO3-+OH-,消耗水电离产生的H+,使溶液中c(OH-)>c(H+),水解产生的HCO3-会进一步发生水解反应:HCO3-+H2O![]() H2CO3+OH-,最终溶液显碱性,而油脂属于酯,在碱性条件下发生水解反应产生可溶性的盐和甘油,因而能够酯类油污;碳酸钠是强碱弱酸盐,水解使溶液显碱性,盐的水解反应是吸热反应,升高温度,盐的水解平衡正向移动,因而促进了盐的水解,最终使溶液碱性增强,盐溶液的碱性增强,则油脂的水解程度会增大,因此使反应充分进行;
H2CO3+OH-,最终溶液显碱性,而油脂属于酯,在碱性条件下发生水解反应产生可溶性的盐和甘油,因而能够酯类油污;碳酸钠是强碱弱酸盐,水解使溶液显碱性,盐的水解反应是吸热反应,升高温度,盐的水解平衡正向移动,因而促进了盐的水解,最终使溶液碱性增强,盐溶液的碱性增强,则油脂的水解程度会增大,因此使反应充分进行;
(2)废铁屑中含氧化铁,所以反应II的离子方程式有Fe2O3+6H+=2Fe3++3H2O、2Fe3++Fe=3Fe2+、Fe+2H+=Fe2++H2↑;若上述反应不再发生,就不能有固体物质溶解和产生气体,因此判断反应II完成的现象是铁屑不再溶解,表面无气泡产生。

【题目】含氮化合物在材料方面的应用越来越广泛。
(1)甲胺(CH3NH2)是合成太阳能敏化剂的原料。工业合成甲胺原理:
CH3OH(g)+NH3(g)![]() CH3NH2(g)+H2O(g)△H。
CH3NH2(g)+H2O(g)△H。
①已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 | C-H | C-O | H-O | N-H | C-N |
键能/kJ·mol-1 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的△H=______________。
②一定条件下,在体积相同的甲、乙、丙、丁四个容器中,起始投入物质如下:
NH3(g)/mol | CH3OH(g)/mol | 反应条件 | |
甲 | 1 | 1 | 498K,恒容 |
乙 | 1 | 1 | 598K,恒容 |
丙 | 1 | 1 | 598K,恒压 |
丁 | 2 | 3 | 598K,恒容 |
达到平衡时,甲、乙、丙、丁容器中的CH3OH转化率由大到小的顺序为_______________。
(2)工业上利用镓(Ga)与NH3在高温下合成固体半导体材料氮化镓(GaN),其反应原理为2Ga(s)+2NH3(g)![]() 2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
2GaN(s)+3H2(g)△H=-30.81kJ·mol-1。
①在密闭容器中充入一定量的Ga与NH3发生反应,实验测得反应体系与温度、压强的相关曲线如图所示。图中A点与C点的化学平衡常数分别为KA和KC,下列关系正确的是_________(填代号)。

a.纵轴a表示NH3的转化率 b.纵轴a表示NH3的体积分数 c.T1<T2 d.KA<Kc
②镓在元素周期表位于第四周期第ⅢA族,化学性质与铝相似。氮化镓性质稳定,不溶于水,但能缓慢溶解在热的NaOH溶液中,该反应的离子方程式为_____________________。
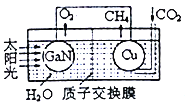
(3)用氮化镓与铜组成如图所示的人工光合系统,利用该装置成功地以CO2和H2O为原料合成CH4。铜电极表面发生的电极反应式为___________。两电极放出O2和CH4相同条件下的体积比为________,为提高该人工光合系统的工作效率,可向装置中加入少量的__________(填“盐酸”或“硫酸”)。
【题目】下列实验不能达到预期实验目的是()
序号 | 实验内容 | 实验目的 |
A | 室温下,用pH试纸测定浓度为0.1mol·L-1NaClO溶液和0.1mol·L-1CH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
C | 向含有少量FeCl3的MgCl2溶液中加入足量Mg(OH)2粉末,搅拌一会过滤 | 除去MgCl2中少量FeCl3 |
D | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
A. A B. B C. C D. D
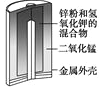
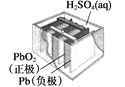
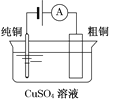
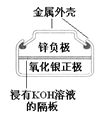
【题目】有关下列四个常用电化学装置的叙述中,正确的是
|
|
|
|
图Ⅰ碱性锌锰电池 | 图Ⅱ铅-硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
A. 图Ⅰ所示电池中,MnO2的作用是催化剂
B. 图Ⅱ所示电池放电过程中,硫酸浓度不断增大
C. 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag