题目内容
【题目】电化学在日常生活中用途广泛,图甲是原电池,电池总反应为Mg+ClO-+H2O=Cl-+ Mg(OH)2,图乙是电解池,用于含Cr2O72-的工业废水的处理。下列说法错误的是
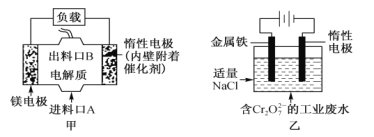
A. 图甲中发生的氧化反应是Mg—2e-=Mg2+
B. 图乙中惰性电极作电解池的阴极,电极棒上有H2放出
C. 图乙中Cr2O72-向惰性电极移动,该极附近有Cr(OH)3生成
D. 若图甲作为图乙的电源,当消耗3.6g镁时,理论上也消耗8.4g铁
【答案】C
【解析】
A.该原电池中,镁作负极,负极上镁失电子发生氧化反应,负极反应式为Mg-2e-=Mg2+,故A正确;
B.图乙阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-=H2↑,所以惰性电极上有氢气生成,故B正确;
C.图乙中惰性电极为阴极,Fe电极为阳极,则Cr2O72-离子向金属铁电极移动,与亚铁离子发生氧化还原反应生成的金属阳离子与惰性电极附近的OH-结合转化成Cr(OH)3除去,故C错误;
D.串联电路中转移电子数相等,若图甲中3.6g镁溶解,电极反应式为Mg-2e-=Mg2+,图乙阳极反应式是Fe-2e-═Fe2+,则图乙中溶解n(Fe)=n(Mg)=![]() =0.15mol,m(Fe)=0.15mol×56g/mol=8.4g,故D正确;
=0.15mol,m(Fe)=0.15mol×56g/mol=8.4g,故D正确;
答案选C。

【题目】下表标出的是元素周期表的一部分元素,回答下列问题:
A | B | C | |||||||||||||||
D | E | F | G | H | I | J | K | ||||||||||
M |
(1)除稀有气体外第三周期中原子半径最小的是_____(填元素符号)
(2)表中用字母标出的12种元素中,化学性质最不活泼的是_____(用元素符号表示,下同),金属性最强的是___(用元素符号表示),属于过渡元素的是___(该空格用表中的字母表示)
(3)以A的最简单氢化物为燃料,D的最高价氧化物对应水化物为电解质溶液的燃料电池,其负极电极反应式为_____
(4)D、F元素最高价氧化物对应水化物相互反应的离子方程式为_____________
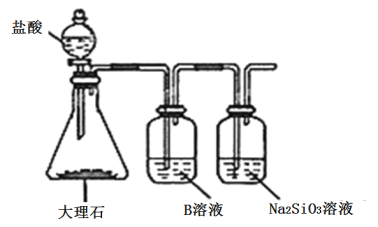
(5)为比较元素A和G的非金属性强弱,用图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_________,能说明A和G非金属性强弱的化学方程式是:______________。