��Ŀ����
����Ŀ���±��������Ԫ�����ڱ���һ����Ԫ�أ��ش��������⣺
A | B | C | |||||||||||||||
D | E | F | G | H | I | J | K | ||||||||||
M |
(1)��ϡ�����������������ԭ�Ӱ뾶��С����_____(��Ԫ�ط���)
(2)��������ĸ�����12��Ԫ���У���ѧ��������õ���_____(��Ԫ�ط��ű�ʾ����ͬ)����������ǿ����___(��Ԫ�ط��ű�ʾ)�����ڹ���Ԫ�ص���___(�ÿո��ñ��е���ĸ��ʾ)
(3)��A������⻯��Ϊȼ�ϣ�D������������Ӧˮ����Ϊ�������Һ��ȼ�ϵ�أ��为���缫��ӦʽΪ_____
(4)D��FԪ������������Ӧˮ�������Ӧ�����ӷ���ʽΪ_____________
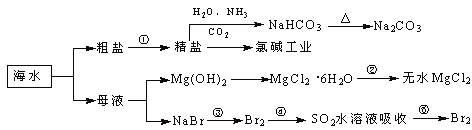
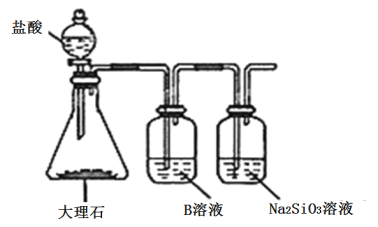
(5)Ϊ�Ƚ�Ԫ��A��G�ķǽ�����ǿ������ͼ��ʾװ�ý���ʵ��(�г���������ȥ��װ������������)����ҺBӦ��ѡ��_____��Һ��������_________����˵��A��G�ǽ�����ǿ���Ļ�ѧ����ʽ�ǣ�______________��
���𰸡�Cl Ar Na M CH4-8e-+10OH- =CO32-+7H2O Al(OH)3+OH���TAlO2��+2H2O ����NaHCO3 ��ȥCO2�е�HCl���� CO2+H2O+Na2SiO3��Na2CO3+H2SiO3��
��������
����Ԫ�����ڱ���AΪCԪ�أ�BΪOԪ�أ�CΪFԪ�أ�DΪNaԪ�أ�EΪMgԪ�أ�FΪAlԪ�أ�GΪSiԪ�أ�HΪPԪ�أ�IΪSԪ�أ�JΪClԪ�أ�KΪArԪ�أ�MΪMnԪ�أ��ݴ˷�����
��1�����������г�ϡ������Ԫ���⣬ԭ�Ӱ뾶��С��ΪClԪ�أ�
��2����12��Ԫ������������õ���ArԪ�أ���������ǿ����NaԪ�أ����ڹ��Ƚ�������MnԪ�أ�
��3��A�ļ��⻯��ΪCH4��D������������Ӧˮ����ΪNaOH����ԭ�ϵ�صĸ�������ʽΪCH4-8e-+10OH-=CO32-+7H2O��
��4��D��FԪ������������Ӧˮ����ֱ�ΪNaOH��Al(OH)3������߷�����Ӧ�����ӷ���ʽΪAl(OH)3+OH-=AlO2-+2H2O��
��5��Ϊ�Ƚ�Ԫ��A��G�ķǽ�����ǿ������ҺBӦ��ѡ�ñ���NaHCO3��Һ�������dz�ȥCO2�е�HCl���ʣ���˵��A��G�ǽ�����ǿ���Ļ�ѧ����ʽ��CO2+H2O+Na2SiO3��Na2CO3+H2SiO3����

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ���±���Ԫ�����ڱ���һ���֣���Ԫ�ط��Ż�ѧʽ��ջش��������⣺
���� ���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | |||
4 | �� | �� |
������ЩԪ���У�����õķǽ���Ԫ����___________����ѧ��������õ�Ԫ����______________��
�Ʊ��н�������ǿ��Ԫ����_______________����ԭ�ӽṹʾ��ͼΪ _______________________ ��
�DZ���Ԫ�ص�����������Ӧ��ˮ������������ǿ����__________�������Ե�����������______��
��Ԫ�آ��Ԫ�ط���Ϊ ____________ ��Ԫ�آߵ�ԭ����Ϊ_________��
���ڢ١���Ԫ���У�ԭ�Ӱ뾶������_____________��ԭ�Ӱ뾶��С����_____________��
��ʮ��Ԫ������һ��Ԫ�ص��⻯��ˮ��Һ�ʼ��ԣ����⻯��ĵ���ʽΪ________��