题目内容
【题目】分解水制氢的一种原理如图,下列关于该原理的说法正确的是( )
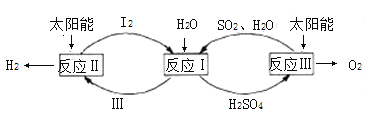
A.反应过程中化合价改变的元素共有H、O、S
B.涉及的反应类型有分解反应和化合反应,且步骤Ⅲ是HI的分解
C.理论上,每生成16gO2,就能得到标准状况下22.4LH2
D.理论上,每分解18gH2O,就需向体系内再补充32gSO2
【答案】C
【解析】
反应I:SO2+2H2O+I2=H2SO4+2HI;
反应II:2HI![]() H2↑+I2;
H2↑+I2;
反应III:2H2SO4![]() 2SO2↑+2H2O+O2↑;
2SO2↑+2H2O+O2↑;
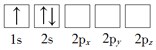
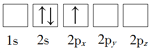
A、根据反应方程式可以看出,反应I中S和I化合价改变。反应II中H和I化合价改变。反应III中S和O化合价改变,所以过程中化合价改变的是H、O、S、I,故A错误;
B、反应II和III都是分解反应,而反应I不是基本反应类型,故B错误;
C、整个过程是碘和二氧化硫做催化剂,在太阳能的作用下水分解成氢气和氧气,所以生成16g氧气就生成2g氢气,标准状况下,氢气的体积为22.4L,故C正确;
D、根据上述反应可知,二氧化硫是催化剂,所以质量在过程中不会减少,不需要向体系内再补充二氧化硫,故D错误;
故选C。

【题目】下表是元素周期表的一部分,用元素符号或化学式填空回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
⑴在这些元素中,最活泼的非金属元素是___________,化学性质最不活泼的元素是______________。
⑵表中金属性最强的元素是_______________,其原子结构示意图为 _______________________ 。
⑶表中元素的最高价氧化物对应的水化物中酸性最强的是__________,呈两性的氢氧化物是______。
⑷元素⑩的元素符号为 ____________ ,元素⑦的原序数为_________。
⑸在①~③元素中,原子半径最大的是_____________,原子半径最小的是_____________。
⑹十种元素中有一种元素的氢化物水溶液呈碱性,该氢化物的电子式为________。