题目内容
【题目】铈(Ce)是![]() 种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:
种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:

已知:CeO2不溶于稀盐酸,也不溶于NaOH溶液。
⑴滤渣的成分是________,反应②的离子方程式是________。
⑵干法空气氧化法回收铈是把Ce(OH)3被空气氧化成Ce(OH)4,氧化过程中发生的化学反应方程式为________。两种制备Ce(OH)4的数据如下表:
干法空气氧化法 | 氧化温度 | 氧化率 | 氧化时间 |
暴露空气中 | 110~120 | 90 | 18 |
在对流空气氧化炉中 | 110~120 | 99 | 8 |
在对流空气氧化炉中大大缩短氧化时间的原因是________。
⑶利用电解方法也可以实现铈的回收。
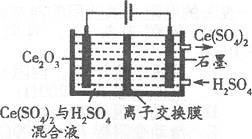
①在酸性条件下电解Ce2O3(如图):阳极电极反应式为________,离子交换膜为________(填“阴”或“阳”)离子交换膜。
②电解产物Ce(SO4)2是重要的氧化剂,将其配成标准溶液,在酸性条件下能测定工业盐中NaNO2的含量,写出发生反应的离子方程式________。
【答案】SiO2、CeO2 H2O2 + 6H+ + 2CeO2 = 2Ce3+ + O2↑+ 4H2O 4Ce(OH)3 + O2 + 2H2O = 4Ce(OH)4 空气对流能使氧气浓度增大,使氧化表面增大 Ce2O3 -2e- + 6H+ = 2Ce4+ + 3H2O 阳 2Ce4+ + NO2-+ H2O = 2Ce3++ 2H+ + NO3-
【解析】
废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质![]() 中加入稀盐酸,Fe2O3转化FeCl3存在于滤液中,滤渣为CeO2和SiO2;加入稀硫酸和H2O2,CeO2转化为Ce3+,滤渣为SiO2;加入碱和氧气后Ce3+转化为Ce(OH)4沉淀,Ce(OH)4分解为CeO2;
中加入稀盐酸,Fe2O3转化FeCl3存在于滤液中,滤渣为CeO2和SiO2;加入稀硫酸和H2O2,CeO2转化为Ce3+,滤渣为SiO2;加入碱和氧气后Ce3+转化为Ce(OH)4沉淀,Ce(OH)4分解为CeO2;
⑴由以上信息得知滤渣的成分,加入稀硫酸和H2O2,CeO2转化为Ce3+,写出反应②的离子方程式;
⑵氧化过程中Ce(OH)3被空气氧化成Ce(OH)4;空气对流能使氧气浓度增大,使氧化表面增大,缩短氧化时间;
⑶①阳极上Ce2O3失电子生成Ce4+,阴极上氢离子得电子,Ce4+透过离子交换膜进入阴极得到Ce(SO4)2;②Ce(SO4)2在酸性条件下被NaNO2还原为Ce3+。
⑴由以上分析可知滤渣的成分是SiO2、CeO2,加入稀硫酸和H2O2,CeO2转化为Ce3+,反应②的离子方程式是H2O2 + 6H+ + 2CeO2 = 2Ce3+ + O2↑+ 4H2O;
故答案为:SiO2、CeO2;H2O2 + 6H+ + 2CeO2 = 2Ce3+ + O2↑+ 4H2O;
⑵氧化过程中Ce(OH)3被空气氧化成Ce(OH)4,发生的化学反应方程式为4Ce(OH)3 + O2 + 2H2O = 4Ce(OH)4;空气对流能使氧气浓度增大,使氧化表面增大,则对流空气使氧化炉中大大缩短氧化时间;
故答案为:4Ce(OH)3 + O2 + 2H2O = 4Ce(OH)4;空气对流能使氧气浓度增大,使氧化表面增大;
⑶①阳极上Ce2O3失电子生成Ce4+,电极反应式为Ce2O3 -2e- + 6H+ = 2Ce4+ + 3H2O,阴极上氢离子得电子,Ce4+透过离子交换膜进入阴极得到Ce(SO4)2,所以离子交换膜为阳离子交换膜为;
故答案为:Ce2O3 -2e- + 6H+ = 2Ce4+ + 3H2O;阳;
②Ce(SO4)2在酸性条件下被NaNO2还原为Ce3+,离子方程式为2Ce4+ + NO2-+ H2O = 2Ce3++ 2H+ + NO3-,故答案为:2Ce4+ + NO2-+ H2O = 2Ce3++ 2H+ + NO3-。

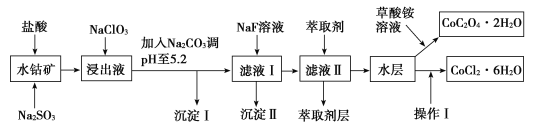
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3目的是___。
(2)NaClO3在浸出液中发生反应的离子方程式为___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为__。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___、__、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为____。[已知:CoC2O4·2H2O的摩尔质量为183g·mol1]