题目内容
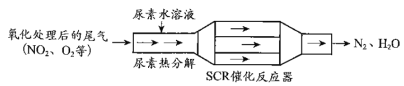
【题目】把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )
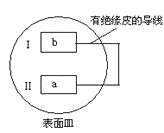
A.a是原电池的负极B.b的活泼性大于a
C.无电流产生D.b 电极上有气泡产生
【答案】A
【解析】
该装置为原电池中的吸氧腐蚀,一段时间后观察到区域I变红色,说明I作正极,氧气得到电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,破坏了水的电离平衡,使得OH-浓度增大,所以Ⅰ处变红,Ⅱ是活泼金属a作负极,失去电子发生氧化反应,据此解答。
A. Ⅱ是活泼金属a作负极,失去电子发生氧化反应,故A正确;
B.a的活泼性大于b,故B错误;
C. 原电池工作时有电流产生,故C错误;
D.b电极作正极,是氧气得电子发生还原反应,无气泡产生,故D错误;
故选A。

【题目】铈(Ce)是![]() 种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:
种重要的稀土元素。以富含CeO2的废玻璃粉末(含SiO2、Fe2O3以及其他少量可溶于稀酸的杂质)为原料,采用多种方法回收铈。请回答下列问题:

已知:CeO2不溶于稀盐酸,也不溶于NaOH溶液。
⑴滤渣的成分是________,反应②的离子方程式是________。
⑵干法空气氧化法回收铈是把Ce(OH)3被空气氧化成Ce(OH)4,氧化过程中发生的化学反应方程式为________。两种制备Ce(OH)4的数据如下表:
干法空气氧化法 | 氧化温度 | 氧化率 | 氧化时间 |
暴露空气中 | 110~120 | 90 | 18 |
在对流空气氧化炉中 | 110~120 | 99 | 8 |
在对流空气氧化炉中大大缩短氧化时间的原因是________。
⑶利用电解方法也可以实现铈的回收。
①在酸性条件下电解Ce2O3(如图):阳极电极反应式为________,离子交换膜为________(填“阴”或“阳”)离子交换膜。
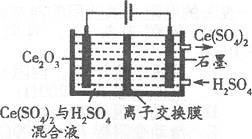
②电解产物Ce(SO4)2是重要的氧化剂,将其配成标准溶液,在酸性条件下能测定工业盐中NaNO2的含量,写出发生反应的离子方程式________。
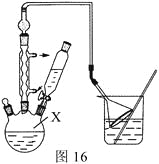
【题目】已知:![]() ,利用下图装置用正丁醇合成正丁醛。相关数据如下:
,利用下图装置用正丁醇合成正丁醛。相关数据如下:

物质 | 沸点/℃ | 密度/(g· | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,正确的是 ( )
A. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
B. 当温度计1示数为90~95℃,温度计2示数在117.2℃左右时,收集产物
C. 反应结束,将馏出物倒入分液漏斗中以分去水层,粗正丁醛从分液漏斗上口倒出
D. 为加快反应,应将酸化的Na2Cr2O7溶液一次性全部加入正丁醇中