题目内容
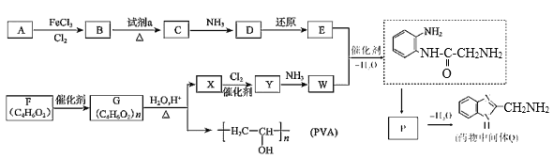
【题目】水杨酸是一种用途极广的消毒防腐剂及医疗保养品,是合成众多药物的中间产物,其工业合成的路线之一如下图所示:

已知:RCH=CHR1 RCOOH+R1COOH
RCOOH+R1COOH
请回答下列问题:
(1)B分子中含氧官能团的名称为_________,D→水杨酸的反应类型为_________。
(2)C转化为D的同时还有一种有机物生成,该物质的结构简式为__________,上述转化过程中B→C的意义是_________;在适当条件下,水杨酸可发生聚合反应生成一种高分子化合物,该化合物的结构简式为__________。
(3)A→B的化学方程式_________。
(4)D有多种同分异构体,符合下列条件的同分异构体最多有_________种,写出核磁共振氢谱有4个峰的物质的结构简式____________。
①是苯的二元取代物;②能发生水解反应及银镜反应
(5)以1,4-二氯丁烷为基本原料制备乙二酸,写出相应的合成路线图(格式为反应物![]() 生成物) ____________
生成物) ____________
【答案】羟基、羧基 取代反应 HOOCCOOH 保护—OH,避免其被KMnO4溶液氧化 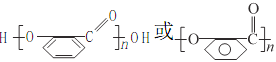
 9
9 ![]() ClCH2CH2CH2CH2Cl
ClCH2CH2CH2CH2Cl![]() CH2=CHCH=CH2
CH2=CHCH=CH2![]() HOOC—COOH
HOOC—COOH
【解析】
由C、D的组成、结构及转化条件可推出C为![]() ,故B为
,故B为![]() ,A为
,A为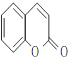 。因B中含有—OH,它易被KMnO4溶液氧化,故B→C的意义是将—OH转化为—OCH3,避免—OH被氧化。D→水杨酸的反应中,D中—CH3被HI中的氢原子代替了,故该反应是取代反应。水杨酸通过发生酯化型的缩聚反应可得到高分子化合物。(4)由①知苯环上有两个取代基,由于知含有酯基且酯基为甲酸酯基。两个取代基可以分别为:—OH~—CH2OOCH、—CH2OH~—OOCH,—OCH3~OOCH。每两个取代基在苯环上均有3种不同的位置关系,故共有9种同分异构体。核磁共振有4种峰,表明结构中存在对称关系,由此可确定其结构简式。(5)根据反应信息知,若要制得乙二酸,需要先制备1.3-丁二烯,故可由原料发生消去反应制得。
。因B中含有—OH,它易被KMnO4溶液氧化,故B→C的意义是将—OH转化为—OCH3,避免—OH被氧化。D→水杨酸的反应中,D中—CH3被HI中的氢原子代替了,故该反应是取代反应。水杨酸通过发生酯化型的缩聚反应可得到高分子化合物。(4)由①知苯环上有两个取代基,由于知含有酯基且酯基为甲酸酯基。两个取代基可以分别为:—OH~—CH2OOCH、—CH2OH~—OOCH,—OCH3~OOCH。每两个取代基在苯环上均有3种不同的位置关系,故共有9种同分异构体。核磁共振有4种峰,表明结构中存在对称关系,由此可确定其结构简式。(5)根据反应信息知,若要制得乙二酸,需要先制备1.3-丁二烯,故可由原料发生消去反应制得。
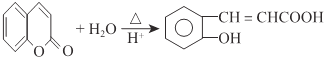
(1)A反水解反应反应生成B,结合A、B分子式可知A为环状酯类物质,B中含有羧基、羟基,D在HI条件下发生水解反应生成水杨酸,属于取代反应,
故答案为:羧基、羟基;取代反应;
(2)结合水杨酸的结构简式,可知B的结构简式为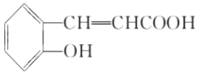 ,再结合B、C、D的转化条件及D的结构简式,可知C为
,再结合B、C、D的转化条件及D的结构简式,可知C为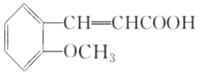 ,C氧化后另外一种有机物为乙二酸,结构简式为HOOC-COOH.因苯环上的酚羟基易被氧化,转化为-OCH3,保护-OH,避免其被KMnO4溶液氧化,水扬酸可发生聚合反应生成一种高分子化合物,该化合物的结构简式为
,C氧化后另外一种有机物为乙二酸,结构简式为HOOC-COOH.因苯环上的酚羟基易被氧化,转化为-OCH3,保护-OH,避免其被KMnO4溶液氧化,水扬酸可发生聚合反应生成一种高分子化合物,该化合物的结构简式为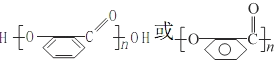 ,
,
故答案为:HOOC-COOH;保护-OH,避免其被KMnO4溶液氧化;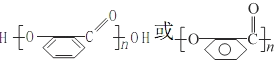 ;
;
(3)A→B发生酯的水解反应生成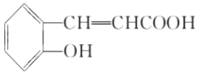 ,A的结构简式为
,A的结构简式为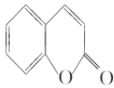 ,反应方程式为:
,反应方程式为: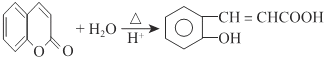 ,
,
故答案为: ;
;
(4)能发生水解反应及银镜反应,说明含有甲酸形成的酯基-OOCH,又是苯的二元取代物,2个取代基为-OOCH、-OCH3,或者为-OOCH、-CH2OH,或者为-CH2OOCH、-OH,各有邻、间、对3种,共有9种,核磁共振氢谱有4个峰的物质的结构简式为:![]() ,
,
故答案为:9;![]() ;
;
(5)ClCH2CH2CH2CH2Cl在氢氧化钠醇溶液、加热条件下发生消去反应生成CH2=CHCH=CH2,然后碱性高锰酸钾溶液氧化,并酸化得到HOOC-COOH,故答案为:ClCH2CH2CH2CH2Cl![]() CH2=CHCH=CH2
CH2=CHCH=CH2![]() HOOC—COOH。
HOOC—COOH。

 高中必刷题系列答案
高中必刷题系列答案【题目】影响化学反应速率的因素很多,某化学小组用实验的方法进行探究。
I.探究活动一:
备选药品:铁片、锌片、0.5mol/LH2SO4、1.5mol/LH2SO4、18.4mol/LH2SO4
甲同学研究的实验报告
实验步骤 | 现象 | 结论 |
①分别取等体积的1.5mol/L的硫酸于两支试管中; ②_____________________。 | 反应速率: 锌>铁 | 金属的性质越活泼,反应速率越快 |
(1)甲同学实验报告中的实验步骤②为__________________________________。
(2)甲同学的实验目的是_______________________________;要得出正确的实验结论,还需控制的实验条件是__________________。
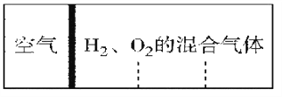
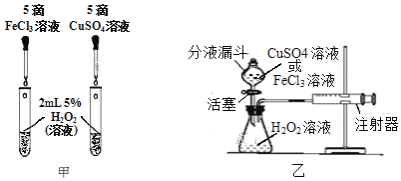
乙同学为了定量研究浓度对化学反应速率的影响,利用如图所示装置进行实验:

(3)乙同学在实验中需要测定的数据是_________________________。
(4)乙同学不会选用___________mol/L硫酸完成该实验,理由是_________________。
II.探究活动二:
备选药品:0.1mol/LNa2S2O3溶液、0.2mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、0.2mol/LH2SO4溶液。
已知:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O
实验 编号 | Na2S2O3用量 | H2SO4用量 | 温度(℃) |
① | 0.1mol/L5mL | 0.1mol/L5mL | 10 |
② | 0.2mol/L5mL | 0.2mol/L5mL | 25 |
③ | 0.1mol/L5mL | 0.1mol/L5mL | 25 |
④ | 0.1mol/L5mL | 0.1mol/L5mL | 40 |
(1)若想探究温度对化学反应速率的影响,可选的实验编号有___________。
(2)若想探究浓度对化学反应速率的影响,可选的实验编号有___________。
(3)在该实验过程中,需要观察和记录________________,来比较化学反应速率的快慢。
(4)Na2S2O3在碱性溶液中可被I2氧化为Na2SO4,写出该反应的离子方程式___________________。