题目内容
【题目】铁(26Fe)、钴(27Co)两种元素均为第四周期元素,它们的用途极为广泛。回答:
(1)26Fe位于元素周期表的第______纵行。
(2)为比较相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果,某研究小组进行了如下探究:
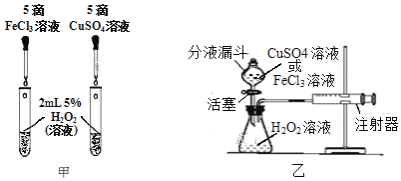
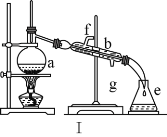
①如图甲,可通过观察______来定性比较两者的催化效果。
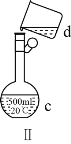
②如图乙,要定量比较两者的催化效果,可测量生成等体积气体所需的______。
③在FeCl3溶液中,究竟是哪种粒子起催化作用?
猜想1:铁离子(Fe3+)起催化作用;
猜想2:______起催化作用;猜想3:______起催化作用;……
若要验证猜想1成立,只需要在图甲的两只试管中分别加入同浓度、同体积的______和______,再通过观察现象,即可证明猜想1成立。
(3)请仔细阅读、分析下列有关利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程图,回答下列问题:
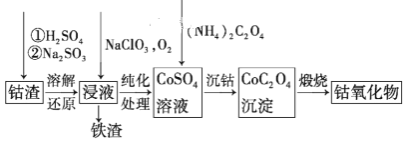
铁渣中铁元素的化合价为______,在空气中煅烧CoC2O4(草酸钴,其中碳为+3价),生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为______。
【答案】四 产生气泡的速率 时间 氯离子(Cl-) 水分子(H2O) FeCl3溶液 AlCl3溶液 +3 Co3O4
【解析】
(1)根据核外电子排布规律分析解答;
(2)根据影响反应速率的因素分析解答;
(3)由制备流程可知,加硫酸溶解后为铁离子,再与亚硫酸钠发生氧化还原反应生成亚铁离子,在浸液中通入氧气时亚铁离子被氧化为铁离子;煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),n(CO2)=![]() =0.06mol,由化学式可知n(Co)=0.06mol×
=0.06mol,由化学式可知n(Co)=0.06mol×![]() =0.03mol,则氧化物中n(O)=
=0.03mol,则氧化物中n(O)=![]() =0.04mol,以此来解答。
=0.04mol,以此来解答。
(1)Fe的原子结构示意图为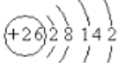 ,则Fe元素位于元素周期表的第四纵行,故答案为:四;
,则Fe元素位于元素周期表的第四纵行,故答案为:四;
(2)①比较两种物质对过氧化氢分解速率的影响,可以观察二者产生气泡的速率,故答案为:产生气泡的速率;
②催化剂的催化效果越好,反应产生气体的速率越快,可通过测量产生等体积的氧气所需要的时间来分析,所需时间越短,催化效果越好,故答案为:时间;
③氯化铁溶液中存在铁离子、氯离子和水分子,故猜想可能是铁离子或氯离子或水分子所起的催化作用;检验是否是铁离子所起的催化作用,只需要在图甲的两只试管中分别加入同浓度、同体积的FeCl3溶液和AlCl3溶液,通过观察现象,即可证明,故答案为:氯离子(Cl-);水分子(H2O);FeCl3溶液;AlCl3溶液;
(3)由制备流程可知,加硫酸溶解后为铁离子,再与亚硫酸钠发生氧化还原反应生成亚铁离子,在浸液中通入氧气时亚铁离子被氧化为铁离子,可知铁渣中铁元素的化合价为+3价;煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),n(CO2)=![]() =0.06mol,由化学式可知n(Co)=0.06mol×
=0.06mol,由化学式可知n(Co)=0.06mol×![]() =0.03mol,则氧化物中n(O)=
=0.03mol,则氧化物中n(O)=![]() =0.04mol,则n(Co):n(O)=0.03mol:0.04mol=3:4,所以钴氧化物的化学式为Co3O4,故答案为:+3;Co3O4。
=0.04mol,则n(Co):n(O)=0.03mol:0.04mol=3:4,所以钴氧化物的化学式为Co3O4,故答案为:+3;Co3O4。
本题考查实验装置的综合应用,为高频考点,把握反应速率测定原理及影响反应速率的因素为解答的关键,侧重分析与实验能力的考查,(3)中化学式的计算为解答的难点,题目难度适中。

【题目】I.下列说法不正确的是_____________(填字母代码)。
A.对于Al(OH)3(s) |
B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
C.能源、信息与材料通常被称为现代社会发展的三大支柱 |
D.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 |
E.除去硬水中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2溶解度比 MgCO3的小
II.向含有AgI的饱和溶液中:
(1)加入固体AgNO3,则c(I-)________(填“变大”、“变小”或“不变”,下同)。
(2)若改加更多的AgI,则c(Ag+)___________。
(3)若改加AgCl固体,则c(I-)___________,而c(Ag+)___________。
III.用“>”、“<”或“=”填空:
(1)25℃时1mol/L FeCl3溶液的pH______80℃时1mol/L FeCl3溶液的pH。
(2)已知NaHSO3溶液中c(HSO3-)>c(SO32-)>c(H2SO3),则溶液中c(H+)______c(OH-)。
(3)常温下,取等物质的量浓度的HA溶液与NaOH溶液等体积混合,测得混合溶液的pH=8,混合溶液中由水电离出的c(H+)水______NaOH溶液中由水电离出的c(H+)水。