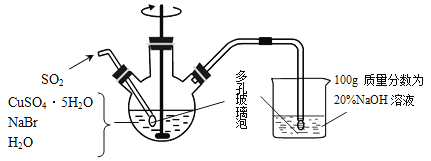
题目内容
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
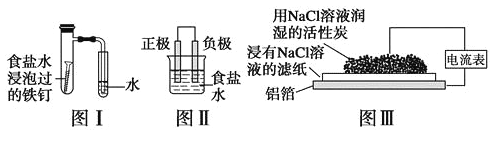
A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
【答案】D
【解析】
试题分析:A、具支试管内气体受热压强增大,不能更快更清晰地观察到液柱上升,故A错误;B、铁做负极,故B错误;C、负极电极反应式为Al-3e-=Al 3+,正极反应式O2+2H2O+4e-═4OH-,总反应方程式为:4Al+3O2+6H2O═4Al(OH)3,故C错误;D、负极电极反应式为Al-3e-=Al 3+,正极反应式O2 + 2H2O + 4e-═4OH-,总反应方程式为:4Al + 3O2 + 6H2O═4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑,故D正确;故选D。

练习册系列答案
相关题目