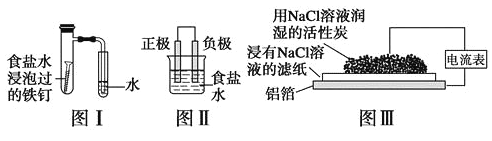
题目内容
【题目】已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。

回答下列问题:
(1)写出A生成的高分子的结构简式 。
(2)B、D分子中的官能团名称分别是 、 。
(3)写出下列反应的反应类型: ① ② 。
(4)写出下列反应的化学方程式:
① ;
④ 。
【答案】(1)![]() ;(2)羟基和羧基;(3)加成反应、氧化反应;(4)CH2=CH2+H2O
;(2)羟基和羧基;(3)加成反应、氧化反应;(4)CH2=CH2+H2O![]() CH3CH2OH,CH3COOH+CH3CH2OH
CH3CH2OH,CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。
【解析】
试题分析:A的产量衡量一个国家的石油化工水平,推出A为乙烯,反应①为和水的加成的反应,则B为CH3CH2OH,乙醇被氧化成CH3CHO,乙醛被氧化成CH3COOH,乙醇和乙酸发生酯化反应生成乙酸乙酯,(1)乙烯的加聚反应:nCH2=CH2→![]() ;(2)B为乙醇含有羟基,D为乙酸含有羧基;(3)反应①为加成反应,反应②为氧化反应;(4)CH2=CH2+H2O
;(2)B为乙醇含有羟基,D为乙酸含有羧基;(3)反应①为加成反应,反应②为氧化反应;(4)CH2=CH2+H2O![]() CH3CH2OH,CH3COOH+CH3CH2OH
CH3CH2OH,CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。

练习册系列答案
相关题目