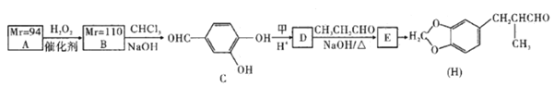
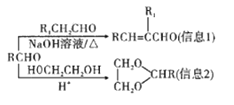
题目内容
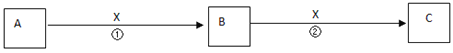
【题目】关于下图所示转化关系(X代表卤素),说法不正确的是
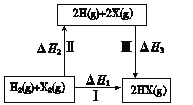
A.2H(g) +2X(g) = 2HX(g) ΔH3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3
C.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
D.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
【答案】D
【解析】
A、形成化学键的过程是放热过程,选项A正确;
B、根据盖斯定律分析途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3正确,选项B正确;
C、放出的热量越多,说明物质的能量越低,其越稳定,选项C正确;
D、非金属性依次减弱,所以单质的中的化学键越不稳定,破坏化学键吸收的能量越小,选项D错误。
答案选D。

练习册系列答案
相关题目
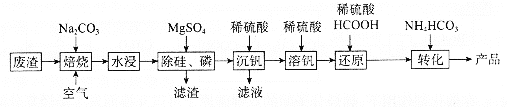
【题目】利用某冶金行业产生的废渣(主要含![]() ,还有少量
,还有少量![]() 、
、![]() 等杂质)可以制备
等杂质)可以制备![]() ,生产流程如下:
,生产流程如下:
已知:![]() 微溶于水、溶于碱生成
微溶于水、溶于碱生成![]() (加热生成
(加热生成![]() ),具有强氧化性。向
),具有强氧化性。向![]() 溶液中加酸,不同
溶液中加酸,不同![]() 对应的主要存在形式如表:
对应的主要存在形式如表:
|
| 10.6~12 | 约8.4 | 3~8 | 约2 | <1 |
存在形式 |
|
|
|
|
|
|
回答下列问题:
(1)“焙烧”后V元素转化为![]() ,
,![]() 元素转化为________(写化学式)。
元素转化为________(写化学式)。
(2)欲除尽磷元素(即![]() ),最终溶液中
),最终溶液中![]() 的浓度至少为________
的浓度至少为________![]() (已知
(已知![]() )。
)。
(3)“沉钒”过程中,![]() 由8.5到5.0发生反应的离子方程式为________;最终需要控制
由8.5到5.0发生反应的离子方程式为________;最终需要控制![]() 约为________;“沉钒”最终得到的主要含钒物质是________(写化学式)。
约为________;“沉钒”最终得到的主要含钒物质是________(写化学式)。
(4)“还原”和“转化”过程中主要反应的离子方程式分为________、________。