题目内容
【题目】下列说法错误的是( )
A.O3与SO2的结构相似
B.硫粉不溶于水,易溶于CS2中
C.Be(OH)2是两性氢氧化物
D.在相同条件下,![]() 的沸点高于
的沸点高于![]()
【答案】D
【解析】
A.O3与SO2的结构相似,都是V型分子,故A正确;
B.根据相似相溶原理,硫粉不溶于水,易溶于CS2中,故B正确;
C.Be与铝处于对角线位置,性质相似,Be(OH)2是两性氢氧化物,故C正确;
D.在相同条件下,![]() 容易形成分子内氢键,使得沸点降低,
容易形成分子内氢键,使得沸点降低,![]() 容易形成分子间氢键,使得沸点升高,故D错误;
容易形成分子间氢键,使得沸点升高,故D错误;
故选D。
【点晴】
常见易形成氢键的化合物:H2O、HF、NH3等.(1)分子间氢键:①同种分子间:以HF为例说明氢键的形成。在HF分子中,由于F的电负性(4.0)很大,共用电子对强烈偏向F原子一边,而H原子核外只有一个电子,其电子云向F原子偏移的结果,使得它几乎要呈质子状态。这个半径很小、无内层电子的带部分正电荷的氢原子,使附近另一个HF分子中含有负电子对并带部分负电荷的F原子有可能充分靠近它,从而产生静电吸引作用,这个静电吸引作用力就是所谓氢键,即F-H…F;②不同种分子间:不仅同种分子之间可以存在氢键,某些不同种分子之间也可能形成氢键.例如 NH3与H2O之间。所以这就导致了氨气在水中的惊人溶解度:1体积水中可溶解700体积氨气;(2)分子内氢键:某些分子内,例如HNO3、邻硝基苯酚分子可以形成分子内氢键,还有一个苯环上连有两个羟基,一个羟基中的氢与另一个羟基中的氧形成氢键,分子内氢键由于受环状结构的限制,X-H…Y往往不能在同一直线上,分子内氢键使物质熔沸点降低。

 走进文言文系列答案
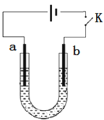
走进文言文系列答案【题目】高铁酸钠(Na2FeO4)是具有紫色光泽的粉末,是一种高效绿色强氧化剂,碱性条件下稳定,可用于废水和生活用水的处理。实验室以石墨和铁钉为电极,以不同浓度的NaOH溶液为电解质溶液,控制一定电压电解制备高铁酸钠,电解装置和现象如下:
c(NaOH) | 阴极现象 | 阳极现象 |
1 mol·L-1 | 产生无色气体 | 产生无色气体,10min内溶液颜色无明显变化 |
10 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,3min后溶液变为浅紫红色,随后逐渐加深 |
15 mol·L-1 | 产生大量无色气体 | 产生大量无色气体,1min后溶液变为浅紫红色,随后逐渐加深 |
下列说法正确的是( )
A.a为石墨,b为铁钉
B.阴极主要发生反应 4OH--4e-== O2↑+ 2H2O
C.高浓度的NaOH溶液,有利于发生Fe-6e-+ 8OH-== FeO42-+ 4H2O
D.制备Na2FeO4时,若用饱和NaCl溶液,可有效避免阳极产生气体