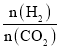题目内容
【题目】下列说法不正确的是( )
A.NH3中氮原子的杂化方式为sp3杂化
B.[Cu(NH3)4]2+中,NH3是配体
C.NH4+、PH4+、CH4、BH4-互为等电子体
D.NH3的沸点比PH3的沸点低
【答案】D
【解析】
A.氨气分子中氮原子价层电子对个数=3+![]() =4,所以N原子采用sp3杂化,故A正确;
=4,所以N原子采用sp3杂化,故A正确;
B.在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,N原子提供孤电子对,所以N原子是配位原子,NH3分子是配体,故B正确;
C.等电子体的原子数相等和价电子数相等,NH4+与PH4+、CH4、BH-4均含有5个原子团,且价电子均为8,为等电子体,属于等电子体,故C正确;
D.NH3和PH3结构相似且都属于分子晶体,分子晶体的熔沸点随着其相对分子质量的增大而增大,但氢键能增大物质的沸点,氨气存在分子间氢键,所以氨气沸点高,故D错误;
故选D。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案【题目】下表为元素周期表前四周期的一部分,下列有关X、Y、Z、R、W五种元素的叙述中,错误的是
X | ||||
Y | Z | |||
R | W |
A.常压下五种元素的单质中,Y的沸点最高
B.元素电负性:X>Z>Y
C.基态原子中未成对电子数最多的是R
D.元素最高价氧化物对应的水化物酸性:W>Z>Y
【题目】现有前四周期的5种元素的部分信息如下表所示:
元素代号 | 元素部分信息 |
X | X的阴离子核外电子云均呈球形 |
Y | 原子的最高能级上有3个未成对电子,其最简单气态氢化物在水中的溶解度在同族元素所形成的最简单气态氢化物中最大 |
Z | 基态原子核外有3个能级填充了电子,能量最高能级的电子数等于前两个能级的电子数之和 |
R | 元素原子的最外层电子排布式为nsn-1npn-1 |
T | 一种核素的质量数为65,中子数为36 |
根据上述元素信息,回答下列问题。
(1)基态T2+的电子排布式为__。
(2)Y、Z、R的电负性由大到小的顺序为__(用元素符号表示)。
(3)YX4+的空间构型为__,离子中![]() 原子的杂化轨道类型为___,YX4+的电子式为__。
原子的杂化轨道类型为___,YX4+的电子式为__。
(4)YX3的一种等电子体分子是__,YX3的键角大于X2Z的键角的主要原因是__。