题目内容
16. Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.(1)E元素在周期表中的位置为第三周期第IIIA族
(2)由A、B、W三种元素组成的18电子微粒的电子式为

(3)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式Cu+2H++H2O2=Cu2++2H2O
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,DA能与水反应放氢气,若将1molDA和1molE单质混合加入足量的水,充分反应后成气全的体积是56L (标准状况下)
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应.若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+
Ⅱ:X、Y、Z为三种不同短周期非金属元素的单质.在一定条件下发生如下反应:
(6)若常温下X、Y、Z均为气体,且A和B化合生成一种固体时的现象是有白烟,则:Y的化学式是H2;生成固体的电子式为
 .
.(7)若常温下Y为固体,X、Z为气体,A 在空气中充分燃烧可生成B,B具有漂白性,则:将B与氯气的水溶液充分反应可生成两种强酸,该反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl.
分析 Ⅰ:A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素,A、D同主族,则D为Na元素,E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期,IIIA族元素,为Al元素,A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素,结合原子结构以及元素对应的单质、化合物的性质可解答该题;
Ⅱ:(6)若常温下X、Y、Z均为气体,且A和B化合生成一种固体时的现象是有白烟,说明是氯化氢和氨气发生的反应,则Y为H2,生成的是氯化铵为氯离子和铵根离子形成的离子化合物;
(7)若常温下Y为固体,X、Z为气体,A 在空气中充分燃烧可生成B,B具有漂白性,说明为SO2,二氧化硫具有还原性氯气具有氧化性,二者在水溶液中发生氧化还原反应生成硫酸和盐酸.
解答 解:Ⅰ:A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素,A、D同主族,则D为Na元素,E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期,IIIA族元素,为Al元素,A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素,则
(1)E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期,IIIA族,
故答案为:第三周期第IIIA族;
(2)由A、B、W三种元素组成的18电子的粒子为CH3OH,为共价化合物,电子式为 ,
,
故答案为: ;
;
(3)Cu和稀硫酸不反应,加入具有氧化性的H2O2,可生成硫酸铜和水,反应的离子方程式为Cu+2H++H2O2=Cu2++2H2O,
故答案为:Cu+2H++H2O2=Cu2++2H2O;
(4)NaH+H2O=NaOH+H2↑
1mol 1mol 1mol
2NaOH+2Al+2H2O=2NaAlO2+3H2↑,
1mol 1mol 1.5mol
n(H2)=1mol+1.5mol=2.5mol,
V(H2)=2.5mol×22.4L/mol=56L,
故答案为:56L;
(5)D的某化合物呈淡黄色,为Na2O2,与氯化亚铁反应的物质的量之比为1:2,且无气体生成,根据质量守恒可知生成物为Fe(OH)3、NaCl和FeCl3,
反应的离子方程式为3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+,
故答案为:3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+;
Ⅱ:(6)X、Y、Z为三种不同短周期非金属元素的单质,若常温下X、Y、Z均为气体,且A和B化合生成一种固体时的现象是有白烟,说明是氯化氢和氨气发生的反应,则Y为H2,生成的是氯化铵为氯离子和铵根离子形成的离子化合物,电子式 ;
;
故答案为:H2; ;
;
(7)、若常温下Y为固体,X、Z为气体,A 在空气中充分燃烧可生成B,B具有漂白性,说明为SO2,A为H2S,所以Y为S,B为O2,X为H2,则:将B与氯气的水溶液充分反应可生成两种强酸,是二氧化硫和氯气在水中发生反应生成硫酸和氯化氢,反应的化学方程式为:SO2+Cl2+2H2O=H2SO4+2HCl;
故答案为:SO2+Cl2+2H2O=H2SO4+2HCl.
点评 本题考查元素的推断和元素化合物知识,题目难度中等,本题侧重于常见化合物的存在为突破口,注重于元素化合物的考查,做题时注意把握题给信息.

| A. | 牛油、纤维素、蛋白质都是高分子化合物 | |
| B. | 淀粉水解的最终产物是葡萄糖 | |
| C. | 棉花和人造丝的主要成分都是纤维素 | |
| D. | 浓硝酸和蛋白质发生反应可使皮肤呈黄色 |
| A. | C6H6+C2H5OH→C6H5-C2H5+H2O | |
| B. | 2NH3+CO2$\frac{\underline{\;180~200℃\;}}{15~30Mpa}$H2O+CO(NH2)2 | |
| C. | NH3+H2O+CO2═NH4HCO3 | |
| D. | CH2=CH2+Cl2+Ca(OH)2→ +CaCl2+H2O +CaCl2+H2O |
| A. | 凡是含有碳元素的化合物都属于有机物 | |
| B. | 易溶于汽油、酒精、苯等有机溶剂中的物质,一定是有机物 | |
| C. | 所有的有机物都很容易燃烧 | |
| D. | 大多数有机物都是共价化合物 |
| A. | C2H5OH | B. | C6H5-CH2-OH | C. | 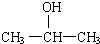 | D. | 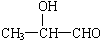 |
| A. | 苯和甲苯不互为同系物 | B. | 淀粉和纤维素互为同分异构体 | ||
| C. | 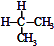 与 与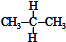 互为同分异构体 互为同分异构体 | D. | 异丁烷与2-甲基丙烷互为同种物质 |
| A. | 利用金属钠 | B. | 利用核磁共振氢谱 | ||
| C. | 利用红外光谱法 | D. | 利用质谱法 |

 +CH3CH2Cl$→_{△}^{AlCl_{3}}$
+CH3CH2Cl$→_{△}^{AlCl_{3}}$ +HCl.
+HCl. .
.